Конформационная лабильность белков
Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых, так как их энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т.е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конфор-мации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Однако белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью - склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке. Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её на-тивной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается. В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка. Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами
3. Четвертичная структура белков. Кооперативные изменения конформации протомеров. Примеры строения и функционирования олигомерных белков: гемоглобин (в сравнении с миоглобином), аллостерические ферменты.
Четвертичная структура - это и количество, и способ укладки полипептидных цепей (протомеров) в пространстве. Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой.Такие агрегаты стабилизируются водородными связями, ионными связями и электростатическими взаимодействиями между остатками аминокислот, находящимися на поверхности глобулы. Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д.
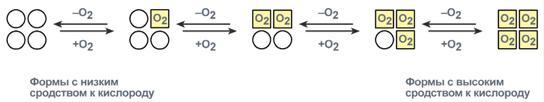 Протомеры связаны друг с другом посредством лишь нековалентных связей (ионных, водородных, гидрофобных). Причем протомеры взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки). Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждый протомер взаимодействует с другим во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны. Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение О2 к гемоглобину. В тканях отдача О2 также ускоряется в 300 раз. Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и т.д. Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных друг от друга. Связывание одного протомера с лигандом изменяет конформацию этого протомера, а также всего олигомера и, кроме того, сродство к другим лигандам. Таким образом, функциональная активность олигомерных белков может регулироваться аллостерическими лигандами.
Протомеры связаны друг с другом посредством лишь нековалентных связей (ионных, водородных, гидрофобных). Причем протомеры взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки). Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждый протомер взаимодействует с другим во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны. Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение О2 к гемоглобину. В тканях отдача О2 также ускоряется в 300 раз. Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и т.д. Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных друг от друга. Связывание одного протомера с лигандом изменяет конформацию этого протомера, а также всего олигомера и, кроме того, сродство к другим лигандам. Таким образом, функциональная активность олигомерных белков может регулироваться аллостерическими лигандами.
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами (обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение; они имеют аллостерический центр, пространственно удалённый от каталитического активного центра; эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах; аллостерические ферменты обладают свойством кооперативности: регуляция аллостерических ферментов обратима). Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Связь между структурой белка и его функцией можно рассмотреть на примере двух родственных белков: миоглобина и гемоглобина:
Миоглобин- мономер (состоит из одной полипептидной цепи), основная его функция - запасание кислорода в тканях. Имея высокое сродство к кислороду, миоглобин легко присоединяет его и отдает кислород только при интенсивной мышечной работе, когда парциальное давление кислорода падает ниже 10 мм рт. ст.
Гемоглобин - тетрамер (состоит из 4х протомеров). Основная функция гемоглобина - обратимое связывание с кислородом в легких, где парциальное давление кислорода высокое и гемоглобин взаимодействует с четырьмя молекулами кислорода.
В тканях СО2 и Н2О, образующиеся при катаболизме пищевых веществ, взаимодействуют с гемоглобином и уменьшают его сродство к кислороду, что облегчает поступление кислорода в ткани.
В эритроцитах имеется также аллостерический лиганд 2,3-дифосфоглицерат, способный взаимодействовать с дезоксигемоглобином. Это препятствует обратному связыванию освободившегося О2 с гемоглобином.
Таким образом, связывание гемоглобина с аллостерическими лигандами в тканях, при относительно высоком парциальном давлении, обеспечивает поступление кислорода в ткани.
Из рассмотренных примеров следует заключить, что аллостерический эффект является результатом связывания лиганда со специфическим участком белка. Это вызывает значительное изменение в белковой молекуле, которая в свою очередь влияет на активность другого, пространственно удаленного участка. Кооперативные изменения конформации олигомерных белков составляют основу механизма регуляции функциональной активности не только гемоглобина, но и многих других белков.
4. Понятие о ферментах. Специфичность действия ферментов. Кофакторы ферментов. Зависимость скорости ферментативных реакций от концентрации субстрата, фермента, температуры и рН. Принципы количественного определения ферментов. Единицы активности.
Ферменты– это катализаторы биологической природы (белки), которые обеспечивают протекание биохимических процессов в живых клетках. Ф. не входят в состав конечных продуктов реакции. Ф. не тратятся в процессе катализа. Ф. только ускоряют реакции, протекающие без них. Ф. не могут возбудить реакции, протекающие по законам термодинамики. Ф. не смещают положение равновеся, а лишь ускоряют его движение. Одна молекула Ф. при обычных условиях может катализировать превращение от тысячи до миллиона молекул в-ва в минуту. Простые ферменты состоят только из АК, а сложные из 2х частей: белковой (апофермент) и небелковой (кофактор). Если кофактор прочно связан с апоферментом, он называется простетической группой, если непрочно – коферментом. Кофактор – это ионы металла или сложные органические соединения, которые выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента (Пр.: в активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции происходит перенос концевого гамма-фосфорного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата).
Особенности:
1. Используются неоднократно; 2. Работают в узком диапазоне t и pH; 3. Катализируют только те реакции, которые биохимически возможны; 4. Обладают каталитической эффективностью; 5. Характерна конформационная лабильность; 6. Способность к регуляции 7. Обладаютспецифичностью: а) субстратная (абсолютная - Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату: аргиназа в реакции расщепления аргинина до мочевины и орнитина; и групповая - Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов: Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира; Относительная групповая специфичность – превращение субстратов с некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000; стереоспецифичность - При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них: к D-сахарам (гексокиназа), к L-аминокислотам, к цистрансизомерам (фумараза), к α- и β-гликозидным связям(амилаза)) В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы:
1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую. 2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.
б) каталитическая - Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата.
Скорость биохим. реакции определяется: а) изменением концентрации реагирующих веществ в единицу времени; б) не является постоянной в течении времени.
Дата добавления: 2015-05-26; просмотров: 3465;
