Гидролиз солей (разобрать первую стадию гидролиза солей, образованных сильным основанием и слабой кислотой, слабым основанием и сильной кислотой).
Взаимодействие ионов соли с водой, в результате которого образуются малодиссоциирующие соединения (ионы или молекулы), называют гидролизом соли
Четыре типа солей, которые по-разному взаимодействуют с водой.
I. Соль образована сильным основанием и сильной кислотой.
NaCI + НОН — ни один из ионов соли с водой не вза-имодействет. Реакция среды нейтральная.
II. Соль образована сильным основанием и слабой кислотой.
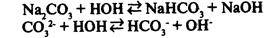 - реакция среды щелочная.
- реакция среды щелочная.
Гидролиз солей, образованных сильным основанием и слабой кислотой, заключается в присоединении анионами кислотного остатка ионов водорода и накоплении в растворе гидроксид-ионов, образующихся при диссоциации воды.
Теперь выясним, почему раствор хлорида алюминия приобрел кислую реакцию среды. В растворе АlСl3 диссоциирует на ионы:
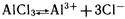
Столкновение ионов Н+ и С– к образованию соединения не приводит. Из имеющихся в растворе ионов малодиссоциирующий продукт образуют ионы Аl3+ и ОН–. Связывание ионов ОН– в малодиссоциирующий ион АlOН2+ (К= 1,38 • 10–9) вызывает дальнейший распад молекул воды на ионы:
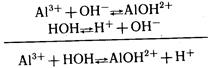
Таким образом, в растворе хлорида алюминия осуществляется реакция, в результате которой появляется избыток ионов Н+, т. е. раствор приобретает кислую реакцию. Подобным образом ведут себя в растворах все соли, образованные слабым основанием и сильной кислотой.
III. Соль образована слабым основанием и сильной кислотой.
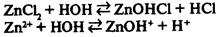 — реакция среды кислая.
— реакция среды кислая.
Гидролиз соли, образованной слабым основанием и сильной кислотой, заключается в присоединении катионами металла гидроксид-ионов и накоплении в растворе ионов водорода, образующихся при диссоциации воды. Гидролиз хлорида алюминия можно выразить уравнением реакции:
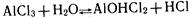
Дата добавления: 2015-04-05; просмотров: 1699;
