Возможность протекания органической реакции. Общие соображения
Во введении мы упоминали привлекательный, но абсолютно нереальный путь синтез уксусной кислоты из метана и углекислого газа (диоксида углерода):
СН4 + СО2 → СН3СООН
А почему, собственно говоря, этот путь нереален? Казалось бы, и элементный состав, и структуры этих трех соединений подсказывают именно такой, самый прямой и короткий путь синтеза. Однако, если смешать метан и углекислый газ, то ничего подобного показанному на схеме не произойдет, какие бы воздействия мы ни прилагали к этой системе. Можно указать по крайней мере две причины, почему столь простая и красивая схема не можег быть реализована.
Первая причина (термодинамический запрет) подобна той, по которой санки легко скатываются с горы, но никогда самопроизвольно в гору не едут. Уксусная кислота богаче энергией, чем смесь метана и диоксида углерода. При определенных условиях она распадается на СН4 и СО2, а обратный процесс самопроизвольно не идет: для этого над системой надо совершить работу.
Вторая причина — кинетический запрет. Если даже та или иная реакция не только хорошо пишется на бумаге, но и разрешена термодинамически (т.е. ее результатом будет уменьшение свободной энергии системы), необходимо еще существование подходящего канала для осуществление желаемого превращения, а именно реального механизма, по которому процесс мог бы протекать. Такого реакционного канала для непосредственного превращения смеси метана и диоксида углерода в уксусную кислоту не существует. Однако органической химии известны обходные пути, позволяющие преодолевать подобные, кажущиеся непреодолимыми препятствия. Вот, например, какой обходной путь совершенно реален для рассматриваемого случая:
СН4 + Вг2 → СН3Вг + НВr
СН3Вг + Mg → CH3MgBr
CH3MgBr + CO2 → CH3COOMgBr
CH3COOMgBr + HBr → CH3COOH + MgBr2
Конечно, такой четырехстадийный синтез выглядит громоздким по сравнению с показанной выше одностадийной схемой, но он имеет то неоспоримое преимущество, что реален: все его четыре стадии представляют собой хорошо идущие и сравнительно несложные по выполнению реакции.
Естественно возникает вопрос: в чем же состоит секрет решения — ведь конечный итог этого обходного пути свелся к тому же, к чему привел бы прямой путь, т.е. к присоединению метана к СО2, Что касается препятствия, названного отсутствием «канала», то обход его состоял именно в том, что в че-тырехстадийном синтезе использованы реально существующие реакции. Разберемся теперь, как же удается обойти термодинамический запрет, т.е. за счет чего все-таки «санки въехали на горку»?
Если суммировать показанную выше последовательность четырех реакций, то она сведется к двум уравнениям:
СН4 + СО2 → СН3СООН
Mg + Вг2 → MgBr2
Теперь мы сможем легко ответить на поставленный вопрос. Энергетический эффект второй, высокоэкзотермической реакции, реакции магния с бромом, с лихвой перекрывает энергетические затраты, требуемые для осуществления первой (целевой) реакции, реакции получения уксусной кислоты. Однако подача энергии в систему сама по себе совсем не обеспечивает возможности протекания химического превращения: совершенно бесполезно сжигать магний в броме и надеяться за счет этого инициировать реакцию диоксида углерода с метаном. Суть дела в другом, а именно в том, что разделив суммарные реакции на отдельные этапы, мы заставили энергию
.второй, донорной в энергетическом отношении реакции выделяться не сразу, а порциями, причем в таких реакциях, в которых участвуют компоненты
' интересующего нас процесса. Поэтому существенная часть этой энергии не
.рассеивается в виде тепла, а совершает химическую работу образования но-вых связей.
, ..; Кроме двух вышеназванных причин, существует еще и третье, независимое осложнение, которое может серьезно помешать осуществлению желаемого превращения органического соединения, а именно возможность реаш-зации ряда различных реакций для одних и тех же исходных веществ. В этой множественности вероятных путей превращения даже простых соединений и заключается одна из главных проблем органического синтеза.
В нашем примере четырехстадийная схема синтеза уксусной кислоты выбрана таким образом, что на каждой ее стадии из ряда возможных реакций для участвующих двух реагентов резко доминирует одна — та, которая показана на схеме. Это обеспечивается как самой природой примененных реагентов, так и правильным выбором условий для проведения данной реакции. Последнее возможно именно потому, что синтез проводится постадийно, вследствие чего каждую из стадий удается проводить в тех условиях, которые являются для нее оптимальными. Заметим, что было бы совершенным безумием попытаться найти условия, при которых все четыре показанные реак-
;.ции можно было бы провести в одной колбе.
• „• Поясним сказанное с помощью такой механической аналогии. Допустим, нам нужно соединить две пластины с отверстиями с помощью болта и гайки. Странно было бы пытаться решить эту задачу путем встряхивания всех деталей в закрытом ящике в надежде на то, что желаемый результат может быть достигнут просто за счет энергии встряхивания.
Рациональный подход в данном случае предполагает разделение суммар-
,'НОго процесса на отдельные операции: сложить пластины, совместить оси отверстий, продеть болт, навернуть гайку. Каждая из этих операций сопря-
жена с характерными только для нее движениями, требует определенной ориентации деталей и нельзя ни проделать все операции одновременно, ни произвольно изменить их порядок.
i Итак, чисто формально технологии решения простейших механических и явно непростых синтетических задач оказываются довольно схожими. Однако одно из принципиальных различий между ними состоит в том, что при разработке адекватной технологии результат механической операции жестко предопределен, а этого нельзя сказать даже об не очень сложном органохи-
i мическом превращении. Ведь химику приходится иметь дело с бесчисленны- ми множествами беспорядочно двигающихся молекул и не вполне очевидно, каким же образом можно добиться того, чтобы эти молекулы реагировали строго определенным образом, что необходимо для обеспечения селективности протекания превращения.
Разберем природу такой избирательности на примере ключевой стадии синтеза уксусной кислоты — реакции метилмагнийбромида с СО2. Метил-магнийбромид — соединение с высокополяризованной связью C–Mg со значительной локализацией положительного заряда на атоме магния (d+), а отрицательного — на атоме углерода (d-). Молекула СО2 также поляризована, но в этом случае частичный положительный заряд локализован на атоме углерода, а отрицательный — на атоме кислорода. Механизм реакции метилмагнийбромида с СО2 сложен и не до конца выяснен. Однако его упрощенное представление, приведенное на схеме 2.1, позволяет правильно понять существо процесса и природу его избирательности.
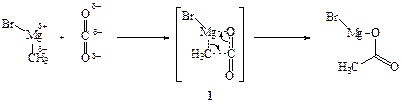 Схема 2.1
Схема 2.1
|
Среди многочисленных вариантов взаимных ориентации соударяющихся молекул СО2 и CH3MgBr можно выделить два типа ситуаций, резко различающихся по последствиям. Если сближающиеся молекулы направлены друг к другу одноименно заряженными участками диполей, то между ними развиваются кулоновские силы отталкивания; сголкнове) ле оказывается упругим — молекулы разлетаются, не претерпев химических изменений. Если же сближающиеся молекулы обращены друг к другу противоположно заряженными участками (см. схему 2.1), то между ними возникает электростатическое притяжение. На достаточно малых расстояниях начинают сказываться внутримолекулярные последствия такого сближения — происходит усиление уже имеющейся поляризации реагентов и тем самым создаются предпосылки к образованию переходного состояния 1, в котором частично разорваны старые связи и частично образовались новые. Переходное состояние богаче энергией по сравнению с исходными соединениями, и эта разница и составляет энергетический барьер данной реакции.
Логическое завершение этого процесса, т.е. перехода через потенциальный барьер, — полное смещение электронной пары одной из связей С=О с образованием связи Mg-O, а пары электронов связи Mg-C с образованием связи С—С. Процесс является энергетически выгодным, поскольку в результате а) возникают прочные ковалентная С-С и ионная О—Mg связи и б) его направленность соответствует естественной тенденции магния терять электроны, а кислорода — их приобретать.
Ввиду принципиальной важности условий термодинамической и кинетической допустимости реакции разберем эти условия несколько с иной точки зрения.
Дата добавления: 2015-04-05; просмотров: 2316;
