Термодинамическая допустимость реакции
Ископаемое сырье, служащее в конечном счете основным исходным материалом для органического синтеза, образовалось в результате чрезвычайно длительных биогеохимических процессов. За это время оно успело достигнуть состояния равновесия или, по крайней мере, к нему приблизиться. Это означает, что соединения, выделяемые из природных источников, приближены к состоянию с минимумом свободной энергии, по крайней мере, в анаэробных условиях. Органический синтез, как правило, имеет целью получение соединений с более высоким содержанием свободной энергии — свободной энергии, запасенной в виде образовавшихся связей и в большей упорядоченности системы, чем исходные вещества*.
Для того чтобы создать такие неравновесные системы, необходимо произвести некоторую работу, энергия для которой должна быть привнесена извне. Это может быть тепловая, электрическая или световая энергия, но чаще всего в органическом синтезе используется химическая энергия.
Источником химической энергии служат химические реагенты, энергия которых была запасена на стадии их приготовления за счет других источников (в конечном счете, как правило, за счет электрической энергии). В примере, рассмотренном выше, такими реагентами являлись магний и бром, полученные в свою очередь электролизом соответствующих солей. Отсюда становится понятным, почему столь большую, подчас ключевую роль в органическом синтезе играют такие высокоактивные реагенты, как свободные галогены (F2, Сl2, Вr2), металлы (например, Li, Na, К, Mg, Zn), простые и комплексные гидриды (например, LiH, NaH, KH, NaBH4, LiAlH4, Bu3SnH, В2Н6) и т. д.
С термодинамической точки зрения органический синтез может быть уподоблен сложному и опасному путешествию в горах со многими подъемами, спусками и обходами препятствий, имеющему своей конечной Целью достижение некоторой точки, расположенной на более высоком уровне, чем исходная. Схематический профиль пути, ведущего от стартового вещества А к конечному продукту Р, представлен на рис. 2.1.
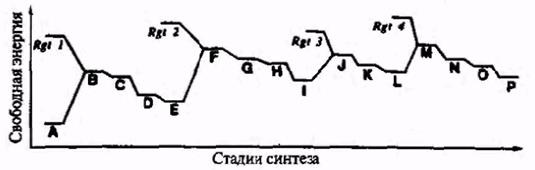 Рис.2.1. Энергетический профиль многостадийного синтеза продукта Р из исходного вещества А (В, С и г.д. — промежуточные продукты, Rgt 1—Rgt 4 — реагенты).
Рис.2.1. Энергетический профиль многостадийного синтеза продукта Р из исходного вещества А (В, С и г.д. — промежуточные продукты, Rgt 1—Rgt 4 — реагенты).
|
Этот рисунок иллюстрирует три важных общих положения, характерных для типичной синтетической последовательности. Во-первых, как видно из схемы, для успешного продвижения по показанному маршруту необходима периодическая «подкачка» свободной энергии, что достигается введением в систему дополнительных регентов Rgt I—Rgt 4. Во-вторых, энергия, запасаемая при этом, может далее расходоваться постепенно, для обеспечения прохождения промежуточных точек (например, С -> D -»Е), что позволяет контролировать ход превращения. Так, в разобранном синтезе уксусной кислоты свободная энергия, внесенная в систему в виде MeMgBr, была далее использована в реакциях с диоксидом углерода, а затем с бромоводородом. В-третьих, очевидно, что промежуточные продукты в данной последовательности обладают некоторым избыточным запасом свободной энергии и, следовательно, они потенциально способны «свалиться в яму», т.е. превратиться в тупиковые, с точки зрения поставленной цели, соединения. Поэтому очень важно иметь возможность направить по нужному руслу энергию, запасаемую на стадиях промежуточных продуктов. Вопрос о факторам, определяющих относительную доступность альтернативных каналов реакции рассмотрен в следующем разделе.
Дата добавления: 2015-04-05; просмотров: 1095;
