Калорические коэффициенты
Внутренняя энергия системы(U), будучи функцией состояния, является функцией независимых переменных (параметров состояния) системы.
В простейших системах будем рассматривать внутреннюю энергию как функцию двух переменных – объема и температуры:
U = f (V, T) (I, 21)
Третья переменная (давление) в этом случае является зависимой переменной и однозначно определяется из значений первых двух.
Тогда полный дифференциал dU будет равен:
dU = 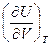 dV +
dV + 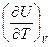 dT (1,22)
dT (1,22)
Подставив значение dU из уравнения (I, 8) в уравнение (I, 2), находим:
δQ = 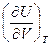 dV +
dV + 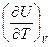 dT + δW (I, 23)
dT + δW (I, 23)
Если в изучаемой системе имеет место только работа расширения и отсутствуют работы электрическая, силы тяготения, поверхностных сил и т. д., то dW = PdV. Тогда
δQ = 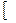
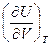 + P
+ P 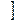 dV +
dV + 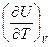 dT (I, 24)
dT (I, 24)
Обозначив коэффициенты при дифференциалах независимых переменных в уравнении (I, 24) символами l и CV, получим:
l = 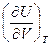 + P (I,25)
+ P (I,25)
CV = 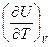 (I,25а)
(I,25а)
Тогда окончательно получим:
δQ = ldV + CVdT (1,26)
Коэффициент l, размерность которого совпадает с размерностью давления, складывается из внешнего давления и члена 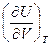 ; который отражает взаимное притяжение молекул. Этот член мал для реальных газов и очень велик (по сравнению с обычными значениями внешнего давления) для жидкостей и твердых тел.
; который отражает взаимное притяжение молекул. Этот член мал для реальных газов и очень велик (по сравнению с обычными значениями внешнего давления) для жидкостей и твердых тел.
Для δQ также запишем выражение, аналогичное (I,22):
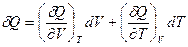 (I,27)
(I,27)
Т.к. в уравнениях (I,24) и (I,27) равны левые части, то равны и правые части:
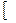
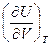 + P
+ P 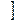 dV +
dV + 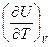 dT =
dT = 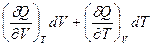
Поскольку V и T – независимые переменные, коэффициенты при соответствующих дифференциалах в правой и левой частях уравнения равны (так называемый метод сравнения коэффициентов). Следовательно:
l = 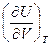 + P =
+ P = 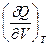 и CV =
и CV = 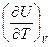 =
= 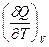
Нетрудно заметить, что CV есть не что иное, как теплоёмкость при постоянном объёме, что следует из определения (I, 14).
Выбрав в качестве независимых переменных P и Т , можно аналогично изложенному получить:
dU = 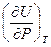 dP +
dP + 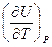 dT
dT
Тогда:

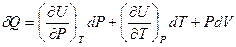 (I,28)
(I,28)
Чтобы избавиться от dV, объём также представим как функцию Р и Т:
V = f (P,T). Тогда:
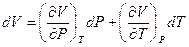 (I,29)
(I,29)
Подставив полученное выражение в (I,28), получим:
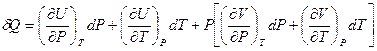
Раскрыв скобки и сгруппировав слагаемые, имеем:
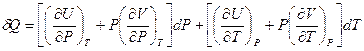 (I,30)
(I,30)
Введём обозначения, как мы уже делали ранее:
h = 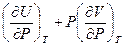 CP =
CP = 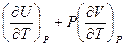 (I,31)
(I,31)
Тогда окончательно имеем:
dQ = hdP + CPdT (I, 32)
Уравнение, аналогичное (I,27) запишется в следующем виде:
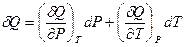
Сравнив его с уравнением (I,30), получим:
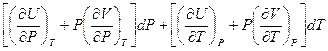 =
= 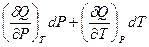
Поскольку P и T – независимые переменные, коэффициенты при соответствующих дифференциалах в правой и левой частях уравнения равны. Следовательно:
h = 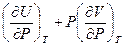 =
= 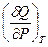 и CP =
и CP = 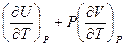 =
= 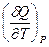 (I, 33)
(I, 33)
CP в данном случае в соответствии с определением (I, 14) есть теплоёмкость при постоянном давлении.
Попробуем найти ответ на ещё один важный вопрос о соотношении между CP и CV . Для этого используем уравнения (I, 26) и (I, 32).
δQ = ldV + CVdT
dQ = hdP + CPdT
Т.к. левые части этих уравнений равны, можно приравнять и их правые части:
ldV + CVdT = hdP + CPdT (I,34)
Из трех переменных P,V и T одна есть функция двух других. Рассматривая объём V как функцию P и T (мы уже делали это ранее): 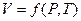 , используем выражение для полного дифференциала dV (I,29). Тогда получим:
, используем выражение для полного дифференциала dV (I,29). Тогда получим:
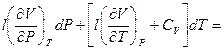 hdP + CPdT
hdP + CPdT
Поскольку P и T – независимые переменные, коэффициенты при соответствующих дифференциалах в правой и левой частях уравнения равны. Следовательно:
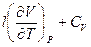 = CP или CP – CV =
= CP или CP – CV = 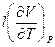 и
и 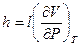 (I,35)
(I,35)
Коэффициенты l, h, CV, и CP называются калорическими коэффициентами. Имея самостоятельный физический смысл (особенно CP, CVи l), они являются также полезными вспомогательными величинами при термодинамических выводах и расчетах.
Дата добавления: 2015-05-21; просмотров: 3087;
