Первый закон термодинамики. Первый закон (первое начало) термодинамики непосредственно связан с законом сохранения энергии
Первый закон (первое начало) термодинамики непосредственно связан с законом сохранения энергии. Он позволяет рассчитывать баланс энергии при протекании различных процессов, в том числе и химических реакций.
Из закона сохранения энергии следует:
Q = ∆U + W (I, 7)
Полученное выражение для закрытой системы может быть прочитано следующим образом: теплота, подведенная к системе, расходуется только на изменение её внутренней энергии и совершение работы.
Или в дифференциальной форме:
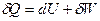 (I, 7а)
(I, 7а)
Приведенное выше утверждение, связанное с уравнениями (I, 3) и (I, 6), служит формулировкой первого закона термодинамики (в сочетании с уравнением (I, 2), дающим количественное определение внутренней энергии).
Первое начало термодинамики является количественной формулировкой закона сохранения энергии в применении к процессам, связанным с превращениями теплоты и работы.
Еще одна формулировка первого закона термодинамики может быть получена из выражения (I, 2а). В изолированной системе dQ = 0 и dW = 0, тогда и dU = 0; следовательно, при любых процессах, протекающих в изолированной системе:
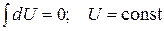 (I,8)
(I,8)
т. е. внутренняя энергия изолированной системы постоянна. Эта формулировка первого закона термодинамики есть примененное к конкретным условиям и конечным системам количественное выражение общего закона сохранения энергии, в соответствии с которым энергия не создается и не исчезает.
Следует отметить, что первый закон термодинамики не дает возможности найти полное значение внутренней энергии системы в каком-либо состоянии, так как уравнения, выражающие первый закон, приводят к вычислению только изменения энергии системы в различных процессах. Точно так же нельзя непосредственно измерить изменение внутренней энергии в макроскопических процессах; можно лишь вычислить это изменение с помощью уравнения (I, 4), учитывая измеримые величины – теплоту и работу данного процесса.
Отметим, что теплота и работа (каждая в отдельности) не обладают свойством функции состояния, выражаемым уравнением (I, 3) или (I, 6) и присущим внутренней энергии. Теплота и работа процесса, переводящего систему из состояния 1 в состояние 2, зависят в общем случае от пути процесса и величины δQ и δW не являются дифференциалами функции состояния, а суть просто бесконечно малые величины, которые мы будем называть элементарной теплотой и элементарной работой.
Таким образом, дифференциал внутренней энергии dU имеет иные математические свойства, чем элементарные теплота dQ и работа dW. Это имеет существенное значение при построении системы термодинамики.
Дата добавления: 2015-05-21; просмотров: 979;
