ПРИНЦИПЫ И ОСНОВЫ ТЕОРИИ ХРОМАТОГРАФИИ.
Хроматографический процесс: удерживание, размывание, разделение.
Основные элементы хроматографического процесса рассмотрим на примере разделения бинарной смеси в условиях колоночной жидкостной адсорбционной хроматографии. Представим себе трубку, заполненную простым адсорбентом (колонку), через которую непрерывно течет растворитель (рис. 1.)
Рисунок 1. Хроматографическая колонка
Адсорбент (сорбент, наполнитель колонки) удерживается в колонке фильтрами, он неподвижен и поэтому называется неподвижной фазой. Растворитель, перемещающийся относительно сорбента, называется подвижной фазой (в некоторых случаях элюентом). Введем в верхнюю часть колонки по одной молекуле соединений - сорбатов, обозначенных дале X и У (рис. 2). При движении вдоль колонки эти молекулы будут диффундировать внутри пор сорбента и, в результате межмолекулярных взаимодействий того или иного типа, адсорбироваться на поверхности неподвижной фазы.
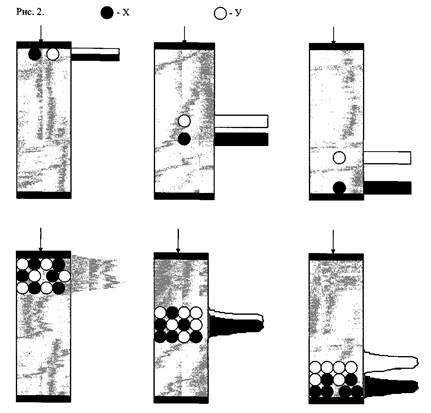
Рисунок 2. Схема хроматографического процесса.
Время, в течение которого молекулы находятся в адсорбированном состоянии, определяется силой межмолекулярного взаимодействия сорбатов X и У с сорбентом. При очень слабой сорбции молекулы почти все время проводят в растворе подвижной фазы и поэтому перемещаются вниз по колонке со скоростью, лишь незначительно уступающей скорости движения подвижной фазы. Наоборот, при очень сильной сорбции молекулы X и У почти не отрываются от поверхности и скорость их перемещения по колонке незначительна.
С точки зрения хроматографии нас больше всего интересуют такие условия, в которых сила адсорбции промежуточная и скорость перемещения X и У по колонке в 2-10 раз меньше скорости движения подвижной фазы. Явление замедленного движения молекул X и У относительно движения подвижной фазы в хроматографии называется удерживанием. Если константы сорбции веществ X и У различны, то различным будет и их средняя скорость движения по колонке. Молекулы X в нашем примере сорбируются слабее, при движении по колонке обгоняют молекулы У и из колонки они выйдут в разные моменты времени. Таким образом, достигается основная цель хроматографии - разделение.
Естественно, что на практике в колонку не вводят единичные молекулы и поэтому данная картинка предельно упрощает реальную ситуацию. Если в колонку введены хотя бы несколько молекул разного вида, то обнаружим, что средние скорости перемещения молекул X и У по-прежнему различны. Помимо этого, скорости перемещения отдельных молекул каждого вида отклоняются в ту или иную сторону от среднего для данного вида значения. Молекулы сорбатов, первоначально введенные в колонку в виде мгновенного импульса, выходят из нее более широкой зоной. Такая неидентичность скоростей перемещения одинаковых молекул в хроматографии называется размыванием. Оно связано с рядом явлений в колонке, которые подробнее рассмотрим позднее. Это нежелательное явление приводит к тому, что среди молекул У могут находиться также молекулы X, скорость которых близка к скорости наиболее "быстрых" молекул У. В результате зоны X и У могут частично наложиться одна на другую и разделение окажется неполным.
Таким образом, при хроматографировании одновременно происходит разделение веществ и размывание хроматографических пиков разделяемых веществ, приводящее к ухудшению разделения. Остановимся на теоретических подходах, объясняющих эти два противоположных процесса хроматографии. Теория хроматографии призвана выявить причины размывания пиков и прогнозировать эффективность разделения смеси веществ.
Хроматографическое разделение определяется различной сорбцией компонентов смеси, что связано с природой сорбента и разделяемых веществ. На основании сведений по термодинамике сорбции (адсорбции, растворения или ионного обмена) можно судить о возможности разделения смеси веществ. Теоретический подход, объясняющий размывание, основан на изучении форм изотерм сорбции — графической зависимости количества вещества в неподвижной фазе cs от его концентрации в подвижной фазе ст при постоянной температуре. Изотерма может быть линейной, выпуклой или вогнутой (рисунок. 3). Угол наклона изотермы определяется коэффициентом распределения D = dcs/dcm.
Форма хроматографического пика и время (объем) удерживания зависят от типа изотермы сорбции. На рис. 3 представлены формы хроматографических пиков и зависимости удерживаемого объема (VR) от концентрации определяемого иона для различных типов изотерм сорбции.
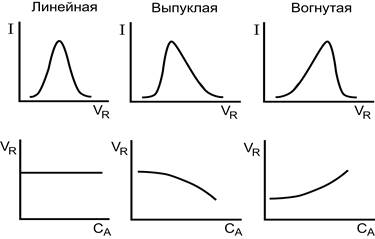
Рисунок 3. Форма хроматографического пика и зависимость удерживаемого объема (VR) от концентрации определяемого иона для различных типов изотерм сорбции.
В случае линейной изотермы пик симметричен, а объем удерживания не зависит от концентрации определяемого иона. (Если изотерма линейна (D = const), зона симметрична. Концентрация вещества максимальна в центре зоны и симметрично убывает к краям. Каждый компонент зоны перемещается с постоянной скоростью, поскольку линейная скорость миграции на единицу длины колонки (v) зависит от скорости потока F (которую устанавливают постоянной) и D: u = F/VR = F/(Vm + DVs). С такой же скоростью перемещается вся зона, оставаясь симметричной. Следовательно, симметричен пик на хроматограмме. Такие пики характерны для линейной хроматографии.)Это идеальный случай. Однако на практике симметричные пики получаются, когда количества вводимых в колонку веществ малы.
Длявыпуклой изотермы хроматографический пик имеет асимметричную форму с размытым задним фронтом (тылом); объем удерживания уменьшается с увеличением концентрации определяемого иона. (Выпуклый характер изотермы свидетельствует о том, что значение D для больших концентраций вещества меньше, чем для малых, следовательно, часть зоны с большей концентрацией перемещается быстрее, чем часть зоны с малой концентрацией. В результате задняя граница хроматограммы (тыл) размывается, а пик получается несимметричным (рис. 8.4, б)).
Обратная картина наблюдается для вогнутой изотермы. В этом случае размыт передний фронт хроматографического пика и объем удерживания увеличивается.
В дальнейшем мы будем рассматривать только теорию линейной хроматографии, характеризующуюся линейной изотермой сорбции, поскольку в большинстве случаев стремятся работать в области линейной изотермы (с малыми пробами веществ). Однако в процессе хроматографического разделения часто происходит размывание пиков. Для объяснения специфического для хроматографии процесса размывания обычно используют теорию теоретических тарелок и кинетическую теорию.
Дата добавления: 2015-05-21; просмотров: 2443;
