Гомодесмічні та гетеродесмічні мінерали
Якщо в кристалі всі атоми пов’язані один із другим однаковими або ж близькими за типом та ступінню ковалентності хімічними зв’язкам, то така структура називається гомодесмічною.
Прикладами гомодесмічних мінералів є самородні метали, діамант, галіт, шпінель, галеніт, сфалерит і такі ж інші.
При одному типі зв’язку можуть існувати декілька варіантів його реалізації, що будуть відрізнятися за силою/міцністю зв’язків, або ж залученням незв’язаних орбіталей. В цьому випадку між деякими групами атомів, внаслідок перекривання незв’язаних орбіталей або ж наявності делокалізованих зв’язуючих орбіталей виникають групи атомів – кластери, зв’язані додатковими зв’язками (переважно металічними).
Якщо ми приймемо, що s – відносна міцність зв’язку, тоді можна розглянути два крайні випадки:
- Якщо sмакс/ sмін = 1 – 3, то отримуємо гомодесмічні структури із подібності будови і енергетичних характеристик катіонів, що входять до їх складу (халькопірит CuFeS2, станін Cu2FeSnS4, шпінель MgAl2O4, фенакіт Be2[SiO4], кіаніт Al2O[SiO4].
- Якщо sмакс/ sмін = 8 – 20 – структури гетеродесмічні.
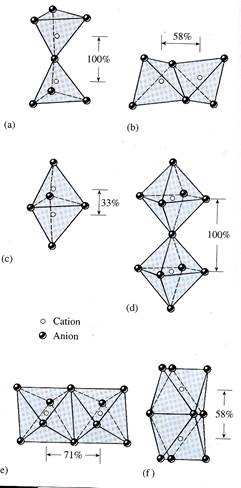
Із ростом sмакс/ sмін відбувається зміна способу з’єднання поліедрів порядку грані à ребра à вершини à за допомогою залишкових зв’язків
Рис. Способи зв’язку координаційних поліедрів – тетраедрів і октаедрів.
а, в, с – зв’язок тетраедрів через вершини, ребра і грані, відповідно; d, e, f – зв’язок октаедрів через вершини, ребра і грані, відповідно. На рисунку показано зміну віддалі між катіонами: приймаючи віддаль у випадку контакту через вершину за 100%. Зменшення віддалі між катіонами збільшує вірогідність перекривання незв’язаних орбіталей і появи у мінералу металічної складової зв’язку. Сильне наближення катіонів у варіанті с робить малоймовірним реалізацію такого варіанту в кристалічних структурах, на відміну від варіанту f, який реалізується в багатьох мінералах.
Гетеродесмічна структура утворюється при залученні хімічних зв’язків різного типу, що відрізняються за ступінню ковалентності-іонності. Вона складається із окремих фрагментів – угрупувань атомів. В межах кожного із фрагментів існує один тип зв’язку, тоді як між собою ці угрупування атомів зв’язуються іншим, звичайно більш слабшим, типом зв’язку. В структурі може існувати декілька типів таких атомних груп, кожний із яких має свої закони повторюваності в структурі і свій спосіб зв’язку із іншими групами. Результуюча структура часто виникає як результат вкладення одних атомних груп в інші (як приклад, можна навести структури слюд, амфіболів чи евдіаліту, детальніше дивіться в розділі ...).
Максимальним проявом гетеродесмічності є утворення структури окси- і сульфосолей із аніонними комплексними радикалами. В таких структурах зв’язки в межах радикалів є міцними донорно-акцепторними, тоді як зв’язок радикалів із катіонами значно слабший ковалентний, іонний або молекулярний.
Кожна кристалохімічна позиція в структурі мінералу характеризуються відповідним коефіцієнтом валентного насичення
- (К).
Коефіцієнт валентного насичення вказує на наявність або відсутність вільних зв’язків в координаційного оточення катіону, на відкритість чи закритість координаційного поліедра. Він визначає здатність координаційного поліедра певної кристалохімічної позиції зв’язуватися із іншими поліедрами у структурі.
Так, якщо К
складає 1/24 – ½ , тоді формуються відкриті атомні конфігурації, в яких координаційні поліедри з’єднуються через ребра та грані; якщо К =
·½ - 1/1, то кристалохімічні позиція із оточенням формує закриті конфігурації, в яких поліедри прямо не зв’язані один із другим.
Дата добавления: 2015-05-21; просмотров: 1079;
