Спектр водню і будова атома водню. Енергетичні рівні в атомі водню.
В атомі водню навколо ядра (протона) рухається один електрон. Враховуючи суттєво більшу масу протона відносно маси електрона (в 1840 разів), можна допустити, що ядро є нерухомим, а орбіти електрона – кругові. На електрон, що обертається навколо протона, діє дві сили: доцентрова і кулонівська, які себе взаємно зрівноважують. Тобто:
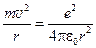 , (6)
, (6)
де 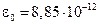 Ф/м. Розв’язуючи рівняння (6) і (4), отримаємо:
Ф/м. Розв’язуючи рівняння (6) і (4), отримаємо:
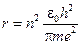 , (7)
, (7)
Використовуючи вираз (7), можна розрахувати радіус будь-якої стаціонарної орбіти електрона. Для прикладу радіус першої орбіти 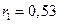 А.
А.
Визначимо повну енергію W електрона в атомі водню. Вона дорівнює сумі кінетичної енергія 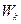 електрона (за його поступального руху на орбіті) і потенціальної енергії Wп (притягання електрона до ядра).
електрона (за його поступального руху на орбіті) і потенціальної енергії Wп (притягання електрона до ядра).
Використавши рівняння (6), отримаємо:
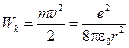 . (8)
. (8)
Потенціальна енергія електрона є від’ємною і чисельно дорівнює:
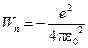 . (9)
. (9)
Враховуючи вирази (8) і (9), отримаємо:
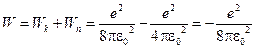 . (10)
. (10)
Підставимо в рівняння (10) вираз для r із формули (7). Отримаємо:
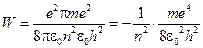 . (11)
. (11)
За умови переходу електрона з однієї стаціонарної орбіти на іншу (ближчу до ядра), випромінюється квант енергії, який дорівнює різниці енергій енергетичних рівнів атома до випромінювання і після нього.
Самовільного переходу електрона на більш високу орбіту не буває. Для такого переходу необхідно надати атому певну порцію енергії.
Розглянута теорія енергетичних станів атома водню може бути застосована і для водневоподібних атомів, тобто до іонів, в яких на зовнішній орбіті знаходиться один електрон (He, Li+, Be2+).
Квантова теорія Бора дала можливість кількісно пояснити особливості спектрів поглинання та випромінювання атомів водню та іонів водневоподібних атомів, однак не годилася для розрахунку спектрів поглинання та випромінювання багатоелектронних атомів. Подальший розвиток теорії, підвалини якої заклав Н. Бор, привів до створення сучасної квантової механіки, котра може кількісно пояснити особливості будови і властивості різних багатоелектронних атомів і молекул.
Дата добавления: 2015-05-19; просмотров: 3349;
