Очищення природних та стічних вод
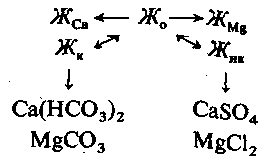
Жорсткість води є одним з найважливіших показників, що визначають шляхи використання води в теплоенергетиці. Загальною жорсткістю води Жо називається сумарна концентрації іонів кальцію і магнію, що виражається в мг-екв/кг, а при малих значеннях – в мкг-екв/кг. По визначальному катіону загальна жорсткість води поділяється на кальцієву ЖСа і магнієву ЖMg. Частина загальної жорсткості, еквівалентна концентрації бікарбонат-іонів і карбонат-іонів у воді, називається карбонатною жорсткістю Жк,а інша частина, еквівалентна іншим аніонам, що містяться у воді (Cl–, SO42– і ін.), називається некарбонатною жорсткістю Жнк:
Загальною лужністю води Ло, мг-экв/кг, називається сумарна концентрація всіх аніонів слабких кислот і іонів гідроксилу за вирахуванням концентрації іонів водню:
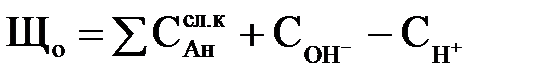 . .
| (1.1) |
Характер аніонів слабких кислот, що обумовлюють загальну лужність, дозволяє підрозділяти її на гідратну лужність (рівну концентрації іонів ОН–), бікарбонатну (НСО3–), карбонатну (СО32–), силікатну (HSiO3–, SiO32–) і фосфатну (Н2РО4–, НРО42–, РО43–).
Зазвичай в природних водах бікарбонатна лужність істотно переважає над іншими видами лужності, тому її значення без великої похибки виражає загальну лужність води. Поправка на концентрацію іонів Н+ при визначенні лужності вводиться при присутності у воді слабких кислот у вільному стані, оскільки при їх дисоціації утворюються в еквівалентних кількостях аніони слабких кислот і аніони Н+ .
Приклад 1.Склад домішок води, мг-екв/кг:
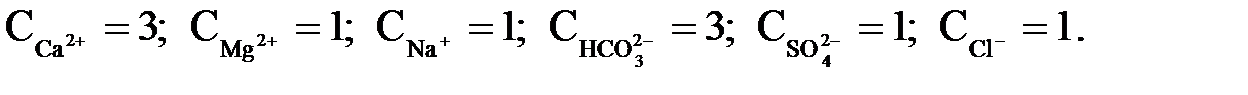
Визначити жорсткість і лужність води.
Перевіримо правильність наданого аналізу:
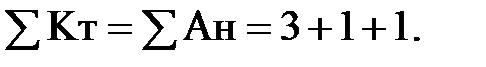
Загальна|загальна| жорсткість води
Жо = ЖСа + ЖMg = 3 + 1 = 4 мг-екв/кг
де ЖСа = 3 мг-екв/кг; ЖMg = 1 мг-екв/кг.
Лужність води
Ло = Лк + Лнк = 3 + 0 = 3 мг-екв/кг
і
Жк = Лк = 3; Жнк = Жо – Жк = 4 – 3 = 1 мг-екв/кг.
Питома електропровідність води, См/см, характеризується електричною провідністю шару води, що знаходиться між двома протилежними гранями куба з ребром, рівним 10–2 м. Вона побічно пов'язана з сумарною концентрацією домішок в істинно-розчиненому стані (солевмістом). У чистій воді, що не містить домішок, перенесення зарядів здійснюється лише іонами Н+ і ОН–. Питома електропровідність такої води при 293 К складає 0,04 мкСм/см. У розчинах зв'язок між електропровідністю і концентрацією іонних домішок залежить від безлічі чинників, у тому числі від температури, виду іонів, ступеня дисоціації, що істотно утрудняє виміри. Більш певний зв'язок існує в розчинах при постійній температурі і ступені дисоціації.
Концентрація розчинених газів у воді залежить від безлічі чинників: природи газу, температури води, ступеня мінералізації води, парціального тиску газу над водою, рН води і т.п. Це у багатьох випадках істотно утрудняє їх аналітичне визначення в технологічних процесах і вимагає спеціальних методів аналізу. Концентрація СО2 в природній воді істотно залежить від ступеня вуглекислотної рівноваги і складає приблизно 0,5 мг/кг (10–5 моль/кг) при 293 К. Концентрація О2 в значній мірі залежить від вмісту у воді органічних речовин і температури. При збільшенні температури від 273 до 308 К концентрація кисню в чистій воді зменшується від 14,6 до 6,5 мг/кг.
Дата добавления: 2015-05-19; просмотров: 981;
