Особенности ферментативного катализа. 1 страница

Ферменты.
5. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад
В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом
катализе фермент Е соединяется (в принципе обратимо) со своим субстра-
том S, образуя нестойкий промежуточный фермент-субстратный комплекс
ES, который в конце реакции распадается с освобождением фермента
и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекул субстрата, всту-
пающих в реакции. Эти представления легли в основу теории «ключа-
замка» Э. Фишера, которую иногда называют теорией «жесткой матрицы».
Таким образом, жесткая структура активного центра оказывается комп-
лементарной молекулярной структуре субстрата, обеспечивая тем самым
высокую специфичность фермента.
Л. Михаэлис не только постулировал образование промежуточного
фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации
субстрата на скорость реакции. В процессе реакции различают несколько
стадий: присоединение молекулы субстрата к ферменту, преобразование
первичного промежуточного соединения в один или несколько последова-
тельных (переходных) комплексов и протекающее в одну или несколько
стадий отделение конечных продуктов реакции от фермента. Это можно
схематически проиллюстрировать следующими примерами:
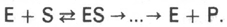
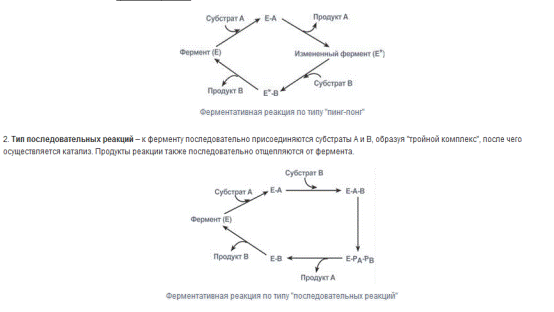
В реакциях анаболизма, например А + В —> АВ, фермент может соединяться
как с одним, так и с другим субстратом или обоими субстратами:

В реакциях катаболизма, например АВ —> А + В:
а) АВ + Е –> ABE
б) АВЕ –> А + BE
в) ВЕ –> В + Е
(а + б + в): АВ + Е –> А + В + Е
. Если фермент в активном центре содержит
кофермент, то предполагается образование тройного комплекса (рис. 4.8).
Фермент вступает во взаимодействие с субстратом на очень короткий
период, поэтому долгое время не удавалось показать образование такого
комплекса. Прямые доказательства существования фермент-субстратного
комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В на-
стоящее время экспериментальные и математические методы кинетики,
термодинамики и статической механики химических реакций позволяют
определить для ряда ферментативных реакций кинетические и термоди-
намические показатели, в частности константы диссоциации промежуточ-
ных фермент-субстратных комплексов, константы скорости и равновесия их
образования.
В образовании фермент-субстратных комплексов участвуют водородные
связи, электростатические и гидрофобные взаимодействия, а в ряде случаев
также ковалентные, координационные связи . Информация о при-
роде связей между субстратом и связывающим участком активного центра
фермента может быть получена методами ЭПР и ЯМР, а также методами
УФ- и ИК-спектроскопии.
Для каталитической активности фермента существенное значение имеет
пространственная структура, в которой жесткие участки α-спиралей че-
редуются с гибкими, эластичными линейными отрезками, обеспечиваю-
щими динамические изменения белковой молекулы фермента. Этим изме-
неням придается большое значение в некоторых теориях ферментативного
катализа. Так, в противоположность модели Э. Фишера «ключ-замок»
Д. Кошлендом была разработана теория «индуцированного соответ-
ствия», допускающая высокую конформационную лабильность молекулы
белка-фермента и гибкость и подвижность активного центра. Эта теория
была основана на весьма убедительных экспериментах, свидетельствующих
о том, что субстрат индуцирует конформационные изменения молекулы
фермента таким образом, что активный центр принимает необходимую для
связывания субстрата пространственную ориентацию. Получены экспериментальные доказательства нового
положения о том, что постулированное Д. Кошлендом «индуцированное
соответствие» субстрата и фермента создается не обязательно изменениями
конформации белковой молекулы, но также геометрической и электрон-
но-топографической перестройкой молекулы субстрата.
В каталитическом процессе существенное значение имеют точное соот-
ветствие между ферментом и субстратом, а также термодинамические
и каталитические преимущества подобного соответствия. Гипотеза «инду-
цированного соответствия» предполагает существование между ферментом
и субстратом не только пространственной или геометрической компле-
ментарности, но и электростатического соответствия, обусловленного
спариванием противоположно заряженных групп субстрата и активного
центра фермента. Точное соответствие обеспечивает образование эффек-
тивного комплекса между субстратом и ферментом.
Подобно другим катализаторам, ферменты, с термодинамической точки
зрения, ускоряют химические реакции за счет снижения энергии активации *.
Энергией активации называется энергия, необходимая для перевода
всех молекул моля вещества в активированное состояние при данной
температуре. Другими словами, это энергия, необходимая для запуска
химической реакции, без которой реакция не начинается несмотря на ее
термодинамическую вероятность. Фермент снижает энергию активации
путем увеличения числа активированных молекул, которые становятся
реакционноспособными на более низком энергетическом уровне
На рисунке видно, что ферментативная реакция имеет более низкую
энергию активации. Следует отметить, что как катализируемая ферментом,
так и не катализируемая им реакция независимо от ее пути имеет одина-
ковую величину стандартного изменения свободной энергии (ΔG). Действуя
на скорость реакции, ферменты не изменяют равновесия между прямой
и обратной реакциями, как и не влияют на величину свободной энергии
реакции; они лишь ускоряют наступление равновесия химической реакции.
Таким образом, в механизме ферментативного катализа ведущую роль
играют промежуточные фермент-субстратные комплексы, образование ко-
торых определяется как тонкой трехмерной структурой активного центра,
так и уникальной структурной организацией всей молекулы фермента,
обеспечивающими высокую каталитическую активность и специфичность
действия биокатализатора.
6. Специфичность ферментов. Ферменты обладают высокой специфич-
ностью действия. Это свойство часто существенно отличает их от неорга-
нических катализаторов. Так, мелкоизмельченные платина и палладий
могут катализировать восстановление (с участием молекулярного водо-
рода) десятков тысяч химических соединений различной структуры. Высо-
кая специфичность ферментов обусловлена, как было отмечено, конфор-
мационной и электростатической комплементарностью между молекулами
субстрата и фермента и уникальной структурной организацией активного
центра, обеспечивающими «узнавание», высокое сродство и избиратель-
ность протекания одной какой-либо реакции из тысячи других химических
реакций, осуществляющихся одновременно в живых клетках.
В зависимости от механизма действия различают ферменты с отно-
сительной (или групповой) и абсолютной специфичностью. Так,
для действия некоторых гидролитических ферментов наибольшее значение
имеет тип химической связи в молекуле субстрата. Например, пепсин
в одинаковой степени расщепляет белки животного и растительного проис-
хождения, несмотря на то что эти белки существенно отличаются друг от
друга как по химическому строению и аминокислотному составу, так и по
физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы,
ни жиры. Объясняется это тем, что точкой приложения, местом действия
пепсина является пептидная —СО—NH-связь. Для действия липазы, ка-
тализирующей гидролиз жиров на глицерин и жирные кислоты, подобным
местом является сложноэфирная связь. Аналогичной групповой специфич-
ностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидроли-
зующие α-гликозидные связи (но не β-гликозидные связи, имеющиеся
в целлюлозе) в полисахаридах, и др. Обычно эти ферменты участву-
ют в процессе пищеварения, и их групповая специфичность, вероятнее
всего, имеет определенный биологический смысл. Относительной специ-
фичностью наделены также некоторые внутриклеточные ферменты, на-
пример гексокиназа, катализирующая в присутствии АТФ фосфорилиро-
вание почти всех гексоз, хотя одновременно в клетках имеются и спе-
цифические для каждой гексозы ферменты, выполняющие такое же фос-
форилирование (см. главу 10).
Абсолютной специфичностью действия называют способность фермента
катализировать превращение только единственного субстрата. Любые из-
менения (модификации) в структуре субстрата делают его недоступным для
действия фермента. Примерами таких ферментов могут служить аргиназа,
расщепляющая в естественных условиях (в организме) аргинин, уреаза,
катализирующая распад мочевины, и др.
Имеются экспериментальные доказательства существования так назы-
ваемой стереохимической специфичности, обусловленной сущест-
вованием оптически изомерных L- и D-форм или геометрических (цис-
и транс-) изомеров химических веществ. Так, известны оксидазы L-
и D-аминокислот, хотя в природных белках обнаружены только L-ами-
нокислоты. Каждый из видов оксидаз действует только на свой спе-
цифический стереоизомер *.
L-аминокислота--1/2О2Оксидаза L-аминокислотàα-Кетокислота + NH3 + Н2О;
D-аминокислота---1/2О2 Оксидаза D-аминокислотà α-Кетокислота + NH3 + H2О.
Наглядным примером стереохимической специфичности является бак-
териальная аспартатдекарбоксилаза, катализирующая отщепление СО2
только от L-аспарагиновой кислоты с превращением ее в L-аланин. Сте-
реоспецифичность проявляют ферменты, катализирующие и синтетические
реакции. Так, из аммиака и α-кетоглутарата во всех живых организмах
синтезируется L-изомер глутаминовой кислоты, входящей в состав при-
родных белков. Если какое-либо соединение существует в форме цис-
и транс-изомеров с различным расположением групп атомов вокруг двой-
ной связи, то, как правило, только один из этих геометрических изомеров
может служить в качестве субстрата для действия фермента. Например,
фумараза катализирует превращение только фумаровой кислоты (транс-
изомер), но не действует на малеиновую кислоту (цис-изомер):
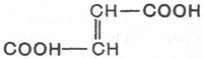
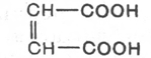
фумаровая кислота Малеиновая кислота
Таким образом, благодаря высокой специфичности действия ферменты
обеспечивают протекание с большой скоростью лишь определенных хи-
мических реакций из огромного разнообразия возможных превращений
в микропространстве клеток и целостном организме, регулируя тем самым
интенсивность обмена веществ.
7. Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Оптимум значения рН у разных ферментов различный (рис. 2-18). Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН (табл. 2-1).
Таблица 2-1. Оптимальные значения рН для некоторых ферментов
| Фермент | Оптимальное значение рН |
| Пепсин | 1,5-2 |
| Пируват-карбоксилаза | 4,8 |
| Каталаза | 6,8-7 |
| Фумараза | 6,5 |
| Уреаза | 6,8-7,2 |
| Кабоксипептидаза | 7,5 |
| Трипсин | 6,5-7,5 |
| Аргиназа | 9,5-9,9 |
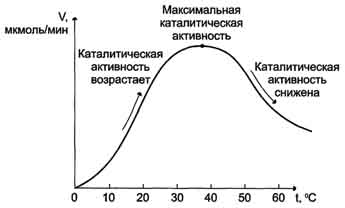
8. Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной

Рис. 2-16. Зависимость скорости ферментативной реакции (V) от концентрации фермента.
реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы (рис. 2-17).
Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).
9. Зависимость скорости ферментативной реакции от количества субстрата
Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой (рис. 2-19).
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г.
Ферментативный процесс можно выразить следующим уравнением:

где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции.
Следующее соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES.
Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):
V =
| Vmax[S] |
| Km + [S] |
Это уравнение получило название уравнения Михаэлиса-Ментен.
В случае, когда скорость реакции равна половине максимальной, Km = [S] (рис. 2-19). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости.
Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
Если концентрация субстрата значительно больше Km (S >> Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата.
Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна
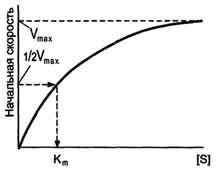
Рис. 2-19. Зависимость скорости реакции (V) от концентрации субстрата S. Vmax - максимальная скорость реакции при данной концентрации фермента в оптимальных условиях проведения реакции. Кm - константа Михаэлиса.
концентрации субстрата (реакция имеет первый порядок).
Vmах и Km - кинетические характеристики эффективности фермента.
· Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше
· Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату.
На рис. 2-20 представлена зависимость скорости двух ферментативных реакций (1 и 2) от концентрации субстрата. Константа Михаэлиса первого фермента меньше константы Михаэлиса второго фермента (Kml < Km2). Следовательно, сродство первого фермента к субстрату выше, чем у второго фермента, и начальная скорость реакции, катализируемой первым ферментом, выше в сравнении со вторым ферментом.
10.
11. Скорость ферментативной реакции, как и активность фермента, в значи-
тельной степени определяется также присутствием в среде активаторов
и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту
реакцию. Активирующее влияние на скорость ферментативной реакции
оказывают разнообразные вещества органической и неорганической приро-
ды. Так, соляная кислота активирует действие пепсина желудочного сока;
Количество продукта
Время
Повышение
концентрации фермента
4х
3х
2х
1х
желчные кислоты повышают активность панкреатической липазы; неко-
торые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), расти-
тельная протеиназа и др. в значительной степени активируются соеди-
нениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд
ферментов – также витамином С. Особенно часто активаторами выступают
ионы двухвалентных и, реже, одновалентных металлов. Получены дока-
зательства, что около четверти всех известных ферментов для проявления
полной каталитической активности нуждаются в присутствии металлов.
Многие ферменты вообще не активны в отсутствие металлов. Так, при
удалении цинка угольная ангидраза (карбоангидраза), катализирующая
биосинтез и распад Н2СО3, практически теряет свою ферментативную
активность; более того, цинк при этом не может быть заменен никаким
другим металлом. Известны ферменты *, действие которых активируется
ионами нескольких металлов; в частности, енолаза активируется Mg2+,
Mn2+, К+ (табл. 4.4).механизм действия металлов в энзиматическом катализе,
или роль металлов в активировании ферментами. В ряде случаев ионы
металлов (Со2+, Mg2+, Zn2+, Fe2+) выполняют функции простетических
групп ферментов, или служат акцепторами и донаторами электронов, или
выступают в качестве электрофилов либо нуклеофилов, сохраняя реактив-
ные группы в необходимой ориентации. В других случаях они способствуют
присоединению субстрата к активному центру и образованию фермент-
субстратного комплекса. Например, ионы Mg2+ через отрицательно заря-
женную фосфатную группу обеспечивают присоединение монофосфатных
эфиров органических веществ к активному центру фосфатаз, катализирую-
щих гидролиз этих соединений. Иногда металл соединяется с субстратом,
образуя истинный субстрат, на который действует фермент. В частности,
ионы Mg2+ активируют креатинфосфокиназу благодаря образованию ис-
тинного субстрата – магниевой соли АТФ. Наконец, имеются эксперимен-
тальные доказательства прямого участия металлов (например, ионов Са2+
* Обычно трудно провести границу между металлоферментами (когда металл связан
прочно с белком и незаменим) и ферментами, активируемыми металлами (последние лишь
ускоряют реакцию и легко диссоциируют).в молекуле амилазы слюны) в формировании и стабилизации активного
центра и всей трехмерной структуры молекулы фермента. Следует отме-
тить также, что металлы нередко выступают в роли аллостерических
модуляторов (эффекторов; см. рис. 4.22). Взаимодействуя с аллостеричес-
ким центром, подобный металл (эффектор) способствует образованию
наиболее выгодной пространственной конфигурации фермента и активного
фермент-субстратного комплекса.
Анионы в физиологических концентрациях обычно неэффективны или
оказывают небольшое активирующее влияние на ферменты. Исключение
составляют пепсин, некоторые оксидоредуктазы, активируемые анионами,
а также амилаза слюны, катализирующая гидролиз крахмала, активность
которой повышается при действии ионов хлора, и аденилатциклаза, кото-
рая активируется анионами галогенов.
12. Ингибиторы ферментов обычно принято делить на два больших
класса: обратимые и необратимые. Это вещества, вызывающие частичное
(обратимое) или полное торможение реакций, катализируемых фермента-
ми. Недавно открыты антиферменты (антиэнзимы, или антизимы),
представляющие собой белки (или полипептиды), действующие как инги-
биторы ферментов. К подобным веществам относятся, например, инги-
битор трипсина, обнаруженный в соевых бобах, и сывороточный анти-
трипсин. Недавно открыт в печени животных антифермент орнитинде-
карбоксилазы (см. главу 12). Антизимы, вероятнее всего, образуют трудно-
диссоциируемые комплексы с соответствующими ферментами, выключая
их из химических реакций. Иногда ингибитор является составным компо-
нентом предшественника фермента, например пепсина (см. главу 12), или
входит в состав сложных комплексов ферментов, например в состав
протеинкиназы и протеинфосфатазы, катализирующих процессы фосфо-
рилирования-дефосфорилирования в живых организмах. Однако до сих
пор не выяснено, являются ли подобные антиферменты истинными инги-
биторами или регуляторными субъединицами, в частности, какова разница
в назначении регуляторной (R) субъединицы в составе протеинкиназы
и ингибиторной (I) субъединицы в составе протеинфосфатазы.
Ферменты являются белками, поэтому любые агенты, вызывающие
денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание),
приводят к необратимой инактивации фермента. Однако подобное инак-
тивирование относительно неспецифично, оно не связано с механизмом
действия ферментов. Гораздо большую группу составляют так называемые
специфические ингибиторы, которые оказывают свое действие на какой-
либо один фермент или группу родственных ферментов, вызывая обрати-
мое или необратимое ингибирование. Исследование этих ингибиторов
имеет важное значение. Во-первых, ингибиторы могут дать ценную инфор-
мацию о химической природе активного центра фермента, а также о составе
его функциональных групп и природе химических связей, обеспечивающих
образование фермент-субстратного комплекса. Известны вещества, вклю-
чая лекарственные препараты, специфически связывающие ту или иную
функциональную группу в молекуле фермента, выключая ее из химической
реакции. Так, йодацетат IСН2—СООН, его амид и этиловый эфир, пара-
хлормеркурибензоат ClHg—С6Н4—СООН и другие реагенты сравнитель-
но легко вступают в химическую связь с некоторыми SH-группами фер-
ментов. Если такие группы имеют существенное значение для акта ката-
лиза, то добавление подобных ингибиторов приводит к полной потере
активности фермента:
R-SH + IСН2—СООН —> НI + R—S—CH2—COOH
Действие ряда других ферментов (холинэстераза, трипсин и химотрип-
син) сильно тормозится некоторыми фосфорорганическими соединениями,
например ДФФ, вследствие блокирования ключевой гидроксильной группы
серина в активном центре (см. ранее).
Во-вторых, ингибиторы нашли широкое применение в энзимологии при
исследовании природы множественных форм ферментов и изоферментов,
различающихся не столько электрофоретической подвижностью, сколько
различной чувствительностью к одному и тому же ингибитору.
При помощи ингибиторов, выключающих отдельные стадии многосту-
пенчатого метаболического процесса, могут быть точно установлены не
только последовательность химических реакций, но и природа участвую-
щих в этих превращениях ферментов. Этим путем, применяя йодацетат,
фториды и другие специфические ингибиторы, был расшифрован глико-
литический путь окислительно-восстановительных превращений глюкозы
до стадии образования молочной кислоты в мышечной ткани, насчиты-
вающий 11 стадий с участием 11 ферментов и 10 промежуточных ме-
таболитов.
С ингибированием ферментов связан механизм действия многих токси-
нов и ядов на организм. Известно, что при отравлениях солями сенильной
кислоты смерть наступает вследствие полного торможения и выключения
дыхательных ферментов (цитохромная система) тканей, особенно клеток
мозга. Токсическое влияние на организм человека и животных некоторых
инсектицидов обусловлено торможением активности холинэстеразы – фер-
мента, играющего ключевую роль в деятельности нервной системы.
Современная, так называемая рациональная, химиотерапия (направлен-
ное применение лекарственных препаратов в медицине) должна основы-
Дата добавления: 2015-04-05; просмотров: 3263;
