Внутренняя энергия реального газа. Сжижение газов.
В идеальном газе отсутствуют молекулярные взаимодействия, поэтому его внутренняя энергия, представляющая собой кинетическую энергию теплового движения молекул, зависит от температуры газа, но не зависит от занимаемого газом объема. В реальных газах нельзя пренебрегать взаимодействием молекул, и потому внутренняя энергия реального газа находится суммированием кинетической энергии движения молекул Ек и потенциальной энергии их взаимодействия Ер:
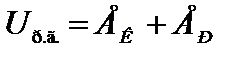
В отличие от идеального газа температура реального газа может изменяться даже в том случае, если его внутренняя энергия остается постоянной, так как она зависит не только от температуры, но и от объема.
Если исключить обмен энергией между газом и внешней средой, то сумма присущей молекулам газа кинетической и потенциальной энергией должна оставаться постоянной. Следовательно, изменение одного из видов энергии должно компенсироваться противоположным изменением второго вида энергии: 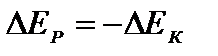 .
.
Рассмотрим явление адиабатического расширения газа в вакуум. Представим себе сосуд, разделенный на две части перегородкой. В одной части находится газ, в другой - вакуум. Если убрать перегородку, то газ устремится в пустую часть сосуда. Так как работа против внешних сил в рассматриваемом случае отсутствует и, по условию, теплообмена нет, то внутренняя энергия газа до и после расширения газа должна быть одинаковой: 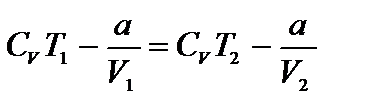 . Изменение температуры:
. Изменение температуры:
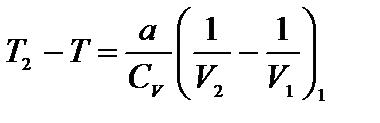
Так как V2>V1, то Т2<T1 (при расширении в пустоту газ Ван-дер-Ваальса охлаждается). Если охлажденной порцией газа охлаждать следующие порции, то можно добиться сжижения газа.
Дата добавления: 2015-04-01; просмотров: 2681;
