Порядок виконання роботи. 1 Відкрийте клапан і визначте початкове значення рівня рідини в одному з колін манометра
1 Відкрийте клапан і визначте початкове значення рівня рідини в одному з колін манометра. Відлік ведіть за нижньою частиною меніска рідини. Вимірювання висоти рівня рідини в одному коліні відносно іншого проводьте так: знайдіть висоту рівня рідини відносно початкового рівня й отримане значення збільшіть удвічі.
2 Закрийте клапан (у ненатисненому стані клапан закритий), накачайте в балон повітря з таким розрахунком, щоб різниця рівнів у колінах манометра була ~ 20 мм (не більше ніж 40 мм).
3 Приблизно через одну хвилину після припинення накачування (рівні рідини в манометрі перестануть змінюватися) визначте різницю рівнів h1 (рис. 3.1.1 та пункт 1). Результат запишіть у табл. 3.1.1.
4 Зрівняйте тиск у балоні з атмосферним. Для цього відкрийте клапан 5 (натисніть на нього), а потім швидко, коли тиск у балоні стане атмосферним, закрийте його (відпустіть клапан).
5 Через кілька хвилин після закриття клапана, коли рівні рідини в манометрі перестануть змінюватися, визначте різницю рівнів h3. Результат запишіть у табл. 3.1.1.
Таблиця 3.1.1
| Номер досл. (і) | h1, мм | h3, мм | γ |
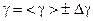 = =
|
6 Повторіть дослід (пп. 2– 5) 5 разів.
7 За розрахунковою формулою (3.1.8) визначте значення gi для кожного досліду. Запишіть ці значення у табл. 3.1.1.
8 Визначте середнє значення 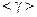 та її випадкову похибку
та її випадкову похибку 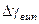 за формулами
за формулами
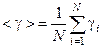 ,
, 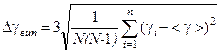 .
.
9 Оцініть похибку, що обумовлена приладами. Для цього застосуйте формулу (використайте дані одного з експериментів)
 .
.
Загальна похибка буде такою:
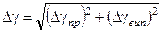 .
.
Обчисліть її та результат запишіть у табл. 3.1.1.
10 Зробіть висновки до лабораторної роботи: запишіть отриманий експериментальний результат у вигляді γ = <γ> ± Δ(γ), порівняйте його зі значенням сталої адіабати, що випливає з класичної теорії теплоємності газів (вважати, що повітря складається з двохатомних газів із жорстким зв’язком, “сухе” повітря складається на 99 відсотків з кисню та азоту ).
Контрольні питання[6])
1 Статистичний і термодинамічний підходи до вивчення теплових властивостей макроскопічних тіл.
2 Термодинамічна система. Параметри стану системи. Рівноважні та нерівноважні стани. Термодинамічний процес. Квазістатичний процес.
3 Температура. Термометр. Загальний (нульовий) закон термодинаміки. Основна властивість температури. Шкала температур Цельсія. Абсолютна температура.
4 Рівняння стану термодинамічної системи. Рівняння стану ідеального газу як результат узагальнення експериментальних досліджень.
5 Основні положення молекулярно-кінетичної теорії речовини.
6 Тиск ідеального газу з погляду молекулярно-кінетичної теорії.
7 Молекулярно-кінетичний зміст абсолютної температури.
8 Внутрішня енергія термодинамічної системи.
9 Робота, що виконується тілом при змінах його об'єму.
10 Кількість теплоти. Перший закон термодинаміки. Вічний двигун першого роду.
11 Теплоємність. Питома і молярна теплоємності. Теплоємність при сталому тиску, при сталому об'ємі. Внутрішня енергія ідеального газу. Рівняння Майєра. Стала адіабати.
12 Рівняння адіабати ідеального газу.
13 Політропічні процеси. Показник політропи. Рівняння політропи.
14 Робота, що виконується газом при: 1) ізобаричному; 2) ізохоричному; 3) ізотермічному; 4) адіабатичному; 5) політропічному процесах.
15 Ступені вільності механічної системи. Теорема про рівномірний розподіл кінетичної енергії за ступенями вільності. Середня енергія молекул. Класична теорія теплоємності ідеального газу.
16 На завершальному етапі виконання експерименту ви відкрили, а потім закрили клапан. Чому після цього тиск у балоні підвищувався? Математично описати цей процес.
17 Описати схему експериментальної установки і сутність виконання лабораторної роботи. Описати за допомогою 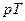 ‑діаграми газові процеси, що відбуваються в балоні під час виконання роботи.
‑діаграми газові процеси, що відбуваються в балоні під час виконання роботи.
18 Отримайте розрахункову формулу, за допомогою якої ви визначали сталу адіабати в даній лабораторній роботі.
3.2 Лабораторна робота
«Дослідження коефіцієнта поверхневого натягу води та впливу на нього поверхнево-активних речовин»
Мета роботи: 1) виміряти коефіцієнт поверхневого натягу води; 2) дослідити залежність коефіцієнта поверхневого натягу від концентрації поверхнево-активних речовин (ПАР).
Обладнання і матеріали: 1) динамометр ДПН; 2) штатив; 3) дротяна петля; 4) пінцет; 5) чашка ємністю 100 см3; 6) піпетка; 7) розчин із поверхнево-активною речовиною (ПАР).
Дата добавления: 2015-05-05; просмотров: 891;
