Критическая температура
Представим себе, что в цилиндре под поршнем содержится перегретый пар. Пусть температура этого пара будет 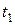 и состояние его определяется на диаграмме точкой 1 (рис. 5.5).
и состояние его определяется на диаграмме точкой 1 (рис. 5.5).
Будем сжимать этот пар, оставляя температуру его неизменной (для чего теплоту от пара нужно отводить). Такой процесс сжатия может быть графически изображен линией 1–2, которая является изотермой перегретого пара. По мере сжатия давление пара, как это видно на диаграмме, будет повышаться, а сам пар все больше приближаться к состоянию насыщения и, наконец, в точке 2 превратиться в сухой пар. При дальнейшем сжатии он перейдет в область влажного пара и будет становиться все более и более влажным (будет конденсироваться), пока не превратится весь в воду (точка 3). Так как такая конденсация происходит при постоянной температуре, то и давление пара должно также оставаться неизменным, а потому изотерма 2–3 будет являться одновременно и изобарой. Дальнейшее сжатие воды будет происходить по линии 3–4. Повторяя такой же процесс для перегретого пара, имеющего более высокую начальную температуру 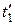 и определяемого на диаграмме точкой
и определяемого на диаграмме точкой 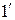 , получим изотерму
, получим изотерму 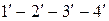 , отличающуюся от первой более коротким горизонтальным участком.
, отличающуюся от первой более коротким горизонтальным участком.
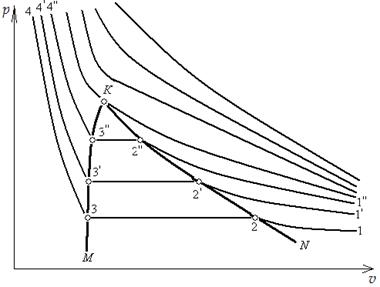
Рис. 5.5. Изображение в осях v р процессов, протекающих
при постоянных температурах
При еще более высокой начальной температуре 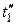 получим изотерму
получим изотерму 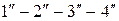 , у которой горизонтальный участок
, у которой горизонтальный участок 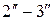 будет еще короче.
будет еще короче.
Наконец, если провести изотерму для пара, имеющего начальную температуру 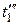 =
= 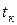 = 374 оС, то эта изотерма не пересечет кривых МК и NK, а только коснется их в критической точке К. Изотермы с температурами больше 374 оС будут проходить выше критической точки, имея над ней некоторый перегиб, который будет тем меньше, чем дальше от нее расположена изотерма и чем, следовательно, выше температура перегретого пара. При очень высоких температурах этот перегиб совсем исчезнет и изотерма примет вид, свойственный изотермам газов.
= 374 оС, то эта изотерма не пересечет кривых МК и NK, а только коснется их в критической точке К. Изотермы с температурами больше 374 оС будут проходить выше критической точки, имея над ней некоторый перегиб, который будет тем меньше, чем дальше от нее расположена изотерма и чем, следовательно, выше температура перегретого пара. При очень высоких температурах этот перегиб совсем исчезнет и изотерма примет вид, свойственный изотермам газов.
Важно отметить, что поскольку изотермы для температур выше критической не пересекают кривых МК и NK, то, следовательно, они лежат в области перегретых паров. Поэтому, если пар имеет температуру выше критической, то сколько бы его ни сжимать при постоянной температуре, он никогда не перейдет в жидкость. Это положение было впервые установлено Д.И. Менделеевым в 1861 г. и может быть сформулировано следующим образом: критической температурой 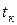 называется такая температура, выше которой пар не может быть переведен при помощи изотермического сжатия в жидкость.
называется такая температура, выше которой пар не может быть переведен при помощи изотермического сжатия в жидкость.
Чем температура перегретого пара выше критической, тем он по своим свойствам больше приближается к идеальным газам. Вообще же перегретый пар можно рассматривать как несовершенный газ, т.е. не вполне подчиняющийся уравнению рv = RT.
Все реальные газы являются парами с очень низкими критическими температурами. В табл. 5.1 приведены значения критических температур и давлений для некоторых газов и водяного пара.
Таблица 5.1
Критические температуры и давления газов и водяного пара
| Название газа | 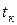 , оС , оС
| 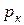 , ата , ата
|
| Водород Н2 Азот N2 Воздух Окись углерода СО Кислород О2 Углекислота СО2 Аммиак NH3 Водяной пар Н2О | –239,71 –146,83 –140,50 –139,40 –118,62 +31,10 +130,70 +374,15 | 12,80 33,50 38,40 35,50 50,80 75,29 114,00 225,65 |
Дата добавления: 2015-04-21; просмотров: 1522;
