Теория Бора. Постулаты Бора. Опыты Франка и Герца.
Первая попытка разобраться в особенностях, свойственных атомам была сделана в 1913 г. известным датским физиком Н. Бором. Бор сделал вывод, что энергия атомов не может меняться непрерывно. Возможные состояния атома образуют дискретную последовательность, и энергия атома в этих состояниях образует дискретный ряд. Изменение состояния (и энергии) атома может происходить лишь в виде скачка - от одного возможного состояния к другому.
В основу своей теории Н. Бор положил два постулата:
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
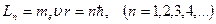
| (23.3.1) |
где me — масса электрона, u — его скорость по n-й орбите радиуса rn. Целое число n равно числу длин волн де Бройля для электронов, укладывающихся на длине круговой орбиты.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией равной разности энергий соответствующих стационарных состояний
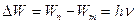 , ,
| (23.3.2) |
где 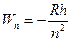 , и Wm — соответственно энергии стационарных состояний атома до и после излучения (поглощения), где R – постоянная Ридберга, n – главное квантовое число,.
, и Wm — соответственно энергии стационарных состояний атома до и после излучения (поглощения), где R – постоянная Ридберга, n – главное квантовое число,.
При Еm<Еn происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еm>Еn — его поглощение (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот квантовых переходов и определяет линейчатый спектр атома.
 |
Изучая методом задерживающего потенциала столкновения электронов с атомами газов (1913), Д. Франк и Г. Герц экспериментально доказали дискретность значений энергии атомов. Принципиальная схема их установки приведена на рис 23.1.
Вакуумная трубка, заполненная парами ртути (давление приблизительно равно 13 Па), содержала катод (К), две сетки (С1 и C2) и анод (А). Электроны, испускаемые катодом, ускорялись разностью потенциалов, приложенной между катодом и сеткой С1. Между сеткой С2 и анодом приложен небольшой потенциал примерно 0,5 В.
Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода.
Согласно боровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний атома.
Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения. При значении энергии ΔЕ = 4,86 эВ энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального энергетического состояния на возбужденный энергетический уровень. Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящего поля и достигнуть анода. Этим и объясняется первое резкое падение анодного тока при ΔЕ =4,86 эВ. При значениях энергии, кратных 4,86 эВ, электроны могут испытать с атомами ртути 2, 3, ... неупругих соударения, потеряв при этом полностью свою энергию, и не достигнуть анода, т. е. должно наблюдаться резкое падение анодного тока, что и видно на графике.
Таким образом, опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только определенные порции энергии, причем 4,86 эВ — наименьшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала экспериментальную проверку.
По известному значению ΔЕ=4,86 эВ можно вычислить длину волны излучения: λ=һс/ΔЕ≈255 нм. Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с λ≈255 нм. Эксперимент действительно обнаруживает одну ультрафиолетовую линию с λ≈254 нм.
Таким образом, опыты Франка и Герца экспериментально подтверждают не только первый, но и второй постулат Бора.
Дата добавления: 2015-04-19; просмотров: 1201;
