ДИНАМИКА СИМПАТО-АДРЕНАЛОВОЙ СИСТЕМЫ ПРИ РАЗВИТИИ СТРЕСС-РАКЦИИ.
При воздействии на организм стрессора развиваются определенные изменения активности САС, последовательность которых такова:
Первой реакцией на действие стрессора является опустошение гипоталамических депо норадреналина, что свидетельствует о первоначальном включении гипоталамуса и других структур ЦНС в развитие ответной реакции на действие стрессора.
Кроме того, активируются пептидэргические системы, обеспечивающих перестройку гипофизарно-адренокортикальной активности.
Предполагают, что именно с активацией норадренэргических структур связано повышение возбудимости ЦНС, которое наблюдают в первую фазу стресса. Действую на чувствительные к катехоламинам элементы ретикулярной формации, НА приводит в состояние повышенной активности норадренэргические элементы головного мозга и тем самым усиливает деятельность всей симпатоадреналовой системы. Следствием этого является повышение синтеза адреналина (А) в надпочечниках, эти процессы обуславливают увеличение уровня НА и А в плазме крови. В результате вторичного захвата способностью к которому обладает миокард, НА накапливается в миокарде, что способствует улучшению сократительной способности миокарда, возрастанию его возбудимости, сократимости, проводимости (положительные ино-, бадмо- и т.д. эффекты). Вслед за этим наблюдается накопление А и в гипоталамусе. Основная часть А в ЦНС имеет надпочечниковое происхождение, куда он проникает через гематоэнцефалический барьер. Его проницаемость для катехоламинов резко ограничена и отмечается только в отдельных зонах гипоталамуса. При развитии стресс-реакции проницаемость гематоэнцефалического барьера по отношению к А увеличивается, причем не только в тригерной зоне гипоталамуса, но и в других областях мозга.
В первую фазу стресса увеличивается выделение А и НА с мочой, что также свидетельствует об активации САС. Известно, что свободные катехоламины, обнаруживаемые в моче, составляют от 0,5% до 6% от общего их количества, подвергаемого метаболизму в организме. Но, несмотря на столь малую экскрецию, изменения их содержания в моче адекватно отражает общие направления сдвигов в САС.
Таким образом, при развитии общего адаптационного синдрома активируется САС, результатом чего являются следующие физиологические эффекты:
стимулируется гликогенолиз в печени, в результате распада гликогена возникает гипергликемия, повышается утилизация глюкозы в скелетных мышцах и некоторых других тканях, стимулируется липолиз и повышается в крови содержание свободных жирных кислот, повышаются тканевое дыхание и температура тела, усиливаются и учащаются сокращения сердечной мышцы, повышается кровяное давление, расширяются коронарные сосуды, расширяются бронхи и усиливается легочная вентиляция, увеличивается возбудимость коры головного мозга, повышается работоспособность скелетных мышц и т.д.
Все эти эффекты, несомненно, имеют адаптивное значение в различных острых стрессорных ситуациях. Активация САС обеспечивает реакции «битва-бегство».
Кроме того, активация САС приводит к стимуляции гипоталамо-гипофизарной – надпочечниковой системы (усиливается активность нейросекреторных клеток, синтез в них рилизинг факторов, функционирование портальной системы, рилизинг факторы стимулируют выработку гормонов аденогипофиза) в частности АКТГ, которые стимулирует выработку глюкокортикоидов: кортизола, гидрокортизола и т. д. (рис. 2.1.2., 2.1.3.).
В результате чего происходит значительное повышение энергетических запасов: возрастает уровень глюкозы (за счет глюконеогенеза) и свободных жирных кислот и т.д.. Однако чрезмерное выделение глюкокортикоидов приводит одновременно и к нежелательным эффектам (это называют платой за адаптацию): резко снижается интенсивность иммунных механизмов, происходит тимиколимфатическая атрофия, возрастает риск образования язв желудка, развития инфаркта миокарда (за счет спазма сосудов), также гипертрофируется кора НП (т.е. все выше перечисленное - триада симптомов, описанная Г. Селье).
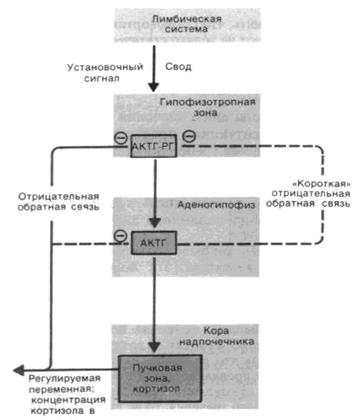
Рис. 2.1.2. Схема регуляции секреции глюкокортикоидов в коре надпочечника посредством КРФ и АКТГ; отрицательная обратная связь тормозит в первую очередь секрецию КРФ (влияя на АКТГ лишь незначительно).
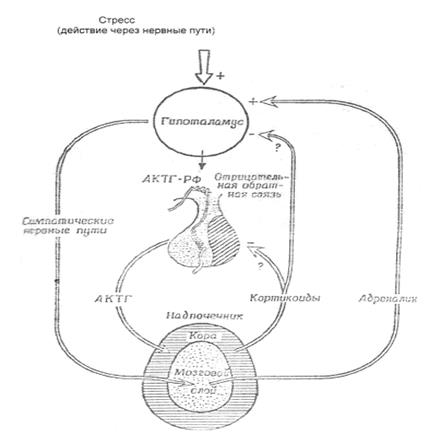
Рис. 2.1.3. Механизмы активации коры надпочечников при стрессе.
Кроме глюкокортикоидов в механизмах развития стресс-реакции важную роль играет гормон роста, тиреоидные и др. гормоны, механизмы, секреции которых сходны с таковой глюкокортикоидов (рис.2.1.4).
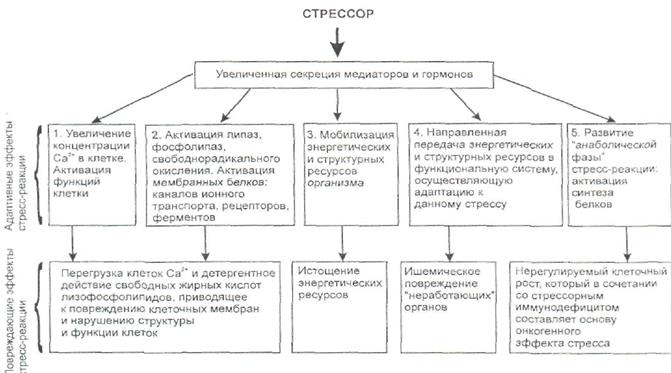
Рис. 2.1.4. Схема адаптивных эффектов стресс – реакции и превращения их в повреждающие эффекты.
Таким образом, при развитии стресс – реакции выделяются многочисленные гормоны, взаимодействующие с рецепторами клеток – мишеней, в результате развиваются адаптивные и повреждающие эффекты стресс-реакции.
В результате активации стресс системы развиваются во многом сопряженных друг с другом эффекты среды стресс – реакции, за счет которых формируется «срочная» адаптация к факторам среды на уровне систем, органов, клеток, но которые при определенных условиях могут превращаться в повреждающие эффекты стресс – реакции (рис. 2.1.4.).
Первый адаптивный эффект стресс-реакции. Возросший "выброс" катехоламинов и других гормонов обеспечивает их увеличенное взаимодействие с соответствующими рецепторами клеток, в результате происходит активация механизма вхождения Са2+ в клетку, повышение его внутриклеточной концентрации, активация протеинкиназ и как следствие - активация внутриклеточных процессов.
Глюкокортикоиды, концентрация которых при стрессе растет проникая в клетку, взаимодействуют с внутриклеточными ядерными рецепторами стероидных гормонов и активируют генетический аппарат клетки, вызывая экспрессию генов регуляторных и структурных белков, что приводит к образованию соответствующих мРНК, синтезу указанных белков и обновлению и росту клеточных структур, ответственных за адаптацию. При повторных действиях стрессора это обеспечивает формирование структурной основы устойчивой адаптации к данному стрессору.
Однако при чрезмерно сильной и или затянувшейся стресс-реакции, возрастающий избыток Са2+ может приводить к повреждению клетки. При этом реализуется так называемая "кальциевая триада" повреждения миоцитов, которая складывается из необратимых контрактурных повреждений миофибрилл, нарушения функции перегруженных кальцием митохондрий и активации миофибриллярных протеаз и митохондриальных фосфолипаз. Все это может приводить к нарушению функции кардиомиоцитов и даже к их гибели и развитию очаговых некрозов миокарда. Этот повреждающий эффект связан с чрезмерным усилением второго адаптивного (липотропного) эффекта стресс-реакции.
Второй адаптивный эффект стресс-реакции состоит в том, что "стрессорные" гормоны активируют липазы, фосфолипазы и увеличивают интенсивность свободнорадикального окисления липидов (СРО), в результате чего повышается содержание свободных жирных кислот, продуктов СРО, фосфолипидов. Этот липотропный эффект стресс-реакции меняет структурную организацию, фосфолипидный и жирнокислотный состав липидного бислоя мембран и тем самым меняет липидное окружение мембраносвязанных функциональных белков, т. е. ферментов, рецепторов, каналов ионного транспорта, ионных насосов, локализованных в мембране.
Адаптивное значение липотропного эффекта стресс-реакции, велико, так как этот эффект может быстро оптимизировать активность всех мембраносвязанных белков, а следовательно, функцию клеток и органа в целом и таким образом способствовать срочной адаптации организма к действию факторов среды. Однако при чрезмерно длительной и интенсивной стресс-реакции усиление именно этого эффекта, может привести к повреждению мембран и это играет ключевую роль в превращении адаптивного эффекта стресс-реакции в повреждающий.
Третий адаптивный эффект стресс-реакции состоит в мобилизации энергетических и структурных ресурсов организма, которая выражается в увеличении в крови концентрации глюкозы, жирных кислот, нуклеотидов, аминокислот, а также в мобилизации функции кровообращения и дыхания. Этот эффект приводит к увеличению доступности субстратов окислению, исходных продуктов биосинтеза и кислорода для органов, работа которых увеличена. Главную роль в мобилизации резерва углеводов и увеличения поступления в кровь глюкозы играют катехоламины и глюкагон за счет прямой активации гликогенолиза и гликолиза через аденилатциклазную систему в печени, скелетных мышцах и сердце. При этом глюкагон выделяется при стрессе несколько позже катехоламинов и как бы дублирует и подкрепляет эффект катехоламинов. Особую значимость это приобретает в условиях, когда действие катехоламинов реализуется не полностью из-за десенситизации b-адренорецепторов, вызванной избытком катехоламинов. В этом случае активация аденилатциклазы осуществляется через глюкагоновые рецепторы.
Другим источником глюкозы является возникающая под влиянием глюкокортикоидов активация глюконеогенеза в печени и скелетных мышцах. Оба гормональных механизма мобилизации глюкозы при стресс-реакции обеспечивает своевременное поступление глюкозы к таким жизненно важным органам, как мозг и сердце.
Мобилизация энергетических и структурных ресурсов выражена при стресс-реакции достаточно сильно и обеспечивает "срочную" адаптацию организма к стрессорной ситуации, т. е. является адаптивным фактором. Однако в условиях затянувшейся интенсивной стресс-реакции, когда не происходит формирования "структурных следов адаптации", иными словами, не происходит увеличения мощности системы энергообеспечения, интенсивная мобилизация ресурсов перестает быть адаптивным фактором и приводит к прогрессирующему истощению организма.
Четвертый адаптивный эффект стресс-реакции может быть обозначен как "направленная передача энергетических и структурных ресурсов в функциональную систему, осуществляющую данную адаптационную реакцию". Одним из важных факторов этого избирательного перераспределения ресурсов является хорошо известная, локальная по своей форме "рабочая гиперемия" в органах системы, ответственной за адаптацию, которая одновременно сопровождается сужением сосудов "неактивных" органов. Действительно при стресс-реакции, вызванной острой физической нагрузкой, доля минутного объема крови, протекающей через скелетные мышцы, возрастает в 4—5 раз, а в органах пищеварения и почках этот показатель, напротив, уменьшается в 5—7 раз по сравнению с состоянием покоя. Известно, что при стрессе развивается увеличение коронарного кровотока, что обеспечивает увеличенную функцию сердца. Возможно, это происходит также за счет других органов. Главная роль в реализации этого эффекта стресс-реакции принадлежит катехоламинам, которые вызывают сужение сосудов в тех органах и тканях, где этому не препятствует "рабочая гиперемия" и мобилизация закрытия запасных капилляров.
Ключевым локальным фактором "рабочей гиперемии", является продуцируемый эндотелием сосудов оксид азота (N0), главный вазодилататор, продукция которого возрастает параллельно росту потребления кислорода. "Рабочая гиперемия" обеспечивает увеличенный приток кислорода и субстратов к работающему органу путем вазодилатации в этом органе. Вместе с тем при чрезмерно выраженной стресс-реакции может развиться ишемия неработающих органов.
Пятый адаптивный эффект стресс-реакциисостоит в том, что при однократном достаточно сильном стрессорном воздействии вслед за "катаболической фазой" стресс-реакции (третий адаптивный эффект) реализуется значительно более длительная "анаболическая фаза". Она проявляется генерализованной активацией синтеза нуклеиновых кислот и белков в различных органах. Эта активация обеспечивает восстановление структур, пострадавших в катаболическую фазу, и является основой формирования структурных "следов" и развития устойчивого приспособления к различным факторам среды. Помимо мобилизации функции клетки и ее энергообеспечения, этот процесс имеет "выход" на генетический аппарат клетки, через действие глюкокортикоидов, что приводит к активации синтеза белков. Кроме того, показано, что в процессе развертывания стресс-реакции активируется секреция "приторможенных" в начале реакции соматотропного гормона (гормона роста), инсулина, тироксина, которые потенцируют синтез белков и могут играть роль в развитии анаболической фазы стресс-реакции и активации роста клеточных структур, на которые приходилась наибольшая нагрузка при стрессорной мобилизации функции клеток. Вместе с тем следует иметь в виду, что чрезмерная активация этого адаптивного эффекта, по-видимому, может приводить к нерегулируемому клеточному росту. В частности, наряду со стрессорным иммунодефицитом, это может играть роль в механизме онкогенного эффекта стресса".
Активность и реактивность стресс-системы регулируются различными механизмами. Важную роль играют процессы саморегуляции (рис.2.4-2.6.). Механизм саморегуляции реализуется за счет влияния друт на друга компонентов самой системы.
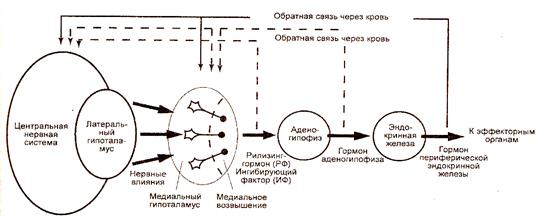
Рис.2.1.5. Связь между нервными и эндокринными механизмами в гипоталамо-гипофизарной системе
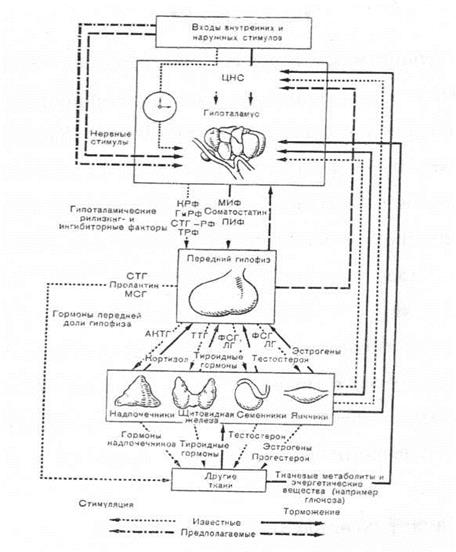
Рис. 2.1.6. Основные петли обратной связи в нейроэндокринной системе, отражающих взаимодействие ее компонентов.
Кроме того, важное значение имеют стресс лимитирующие системы, способные ограничивать активность стресс-системы и чрезмерную стресс-реакцию на центральном и периферическом уровнях регуляции.
Дата добавления: 2015-04-19; просмотров: 3137;
