Глава 3. Модель увеита
В данной работе использовалась модель токсико-аллергического увеита, поэтому подробнее остановимся на патогенезе именно этой разновидности заболевания.
введение лошадиной сыворотки кроликам приводит к образованию антител Каждому виду животных свойственна характерная динамика образования иммуноглобулинов. Она зависит от дозы антигена, пути проникновения его в организм и состояния реактивности организма. при первичном парентеральном введении антигена кроликам антитела обнаруживаются в сыворотке крови спустя 3-4 дня. В течение 6-12 дней титр антител нарастает, затем стабилизируется, а затем в течение 2-3 месяцев постепенно возвращается к исходному уровню. при первичном подкожном введении антигена в процесс иммунного ответа вовлекаются регионарные лимфоузлы. При введении антигена в процессе реакции антиген-антитело образуются иммунные комплексы. Они обладают сродством к тканям, взаимодействуют с комплементом и вызывают следующие явления: дегрануляцию тканевых базофилов, повышение содержания эозинофилов, повышение проницаемости капилляров, пролиферацию эндотелия, активацию нейтрофилов с развитием "респираторного взрыва" и выбросом широкого спектра протеолитических ферментов. Элиминацию иммунных комплексов осуществляют макрофаги и нейтрофилы.
Повторное введение антигена в глаз приводит к иммунному конфликту в сосудистой оболочке глаза, так как иммунные комплексы тропны к кровеносным сосудам. Циркулирующие ИК фиксируются на сосудистой стенке, активируют нейтрофилы, которые начинают выделять биооксиданты, эластино- и коллагенолитические ферменты, вследствие чего увеличивается проницаемость сосудов, и развивается острый деструктивный процесс.
После завершения острой фазы воспаления состав клеточного инфильтрата меняется – вместо нейтрофилов в нем начинают преобладать макрофаги и моноциты, которые нацелены на удаление иммунных комплексов.
Угнетение клеточного и выраженная реакция гуморального иммунитета при системных заболеваниях приводит к развитию хронических рецидивирующих аутоиммунных увеитов.
ГЛАВА № 6. МАТЕРИАЛЫ И МЕТОДЫ.
6.1.Моделирование увеита.
Увеит моделировали по методу Baldwin [46], модифицированному в МНИИ ГБ им. Гельмгольца [31] путем двукратного введения животным нормальной лошадиной сыворотки. Первая доза сыворотки (5 мл) вводилась подкожно, вторая (0,07 мл) – интравитреально на 10 день после первой.
В результате развивался панувеит, однако мы оценивали проявления переднего увеита, поскольку быстро развивавшееся помутнение хрусталика не позволяло наблюдать состояние заднего отрезка глаза.
6.2.Оценка визуально наблюдаемых проявлений увеита.
Основные наблюдаемые проявления увеита оценивали в условных единицах. Оценку проводили путем биомикроскопии с помощью щелевой лампы.
В работе для оценки изменения показателей интенсивности воспаления использована принятая в лаборатории условная шкала, характеризующая выраженность признака в баллах от 1 до 3.
Табл.6.2.1.Схема оценки выраженности симптомов при экспериментальном увеите у кроликов.
| Признак | Выраженность клинических проявлений | Баллы |
| Отек век | слабо выраженный выраженный резко выраженный | |
| Гиперемия конъюнктивы | легкая выраженная резко выраженная | |
| Отек роговицы | рисунок радужки виден рисунок радужки не виден радужка не видна | |
| Отек радужки | гиперемия и слабо выраженный отек выраженный резко выраженный | |
| Количество фибрина в передней камере | незначительное среднее большое |
Эксперимент выполнен на 20 кроликах. У 16 кроликов моделировали увеит по описанной выше методике.
Кролики с увеитом (16 кроликов, 32 глаза) были разбиты на 2 группы по 8 животных. Одной группе ежедневно в течение 7 дней, начиная со дня введения разрешающей дозы, проводили инстилляции
Для лечения использовали препарат
Ежедневно проводили клиническую оценку течения увеита путем биомикроскопии с помощью щелевой лампы.
На 5-е сутки увеита у 4 кроликов из каждой группы отбирали из каждого глаза около 0,15 мл влаги передней камеры и выводили животных из эксперимента. На 8-е сутки забирали влагу передней камеры у оставшихся животных. Для контроля каждый раз забирали влагу передней камеры у 4 здоровых животных.
Слезную жидкость у животных забирали до увеита, на 1, 3 и 7 сутки увеита. Для контроля одновременно забирали слезную жидкость у 4 здоровых животных.
2. Сравнение эффективности инстилляций мелатонина, Дексаметазона и их сочетания при экспериментальном увеите у кроликов.
Взятие биологического материала.
Слезную жидкость у кроликов забирали следующим образом: кружки из фильтро-вальной бумаги Ø5мм (3 кружка на 1 глаз) помещали в нижний конъюнктивальный мешок на 5 минут. Далее их переносили в пробирки эппендорф, элюировали буферным раствором (150 мкл) в течение 20 мин. Элюат центрифугировали, надосадочную жидкость использовали для определения активности СОД в тот же день.
Влагу передней камеры глаза забирали путем парацентеза инсулиновым шприцем после местной анестезии 0,4% Алкаином. После взятия водянистой влаги отбирали 20 мкл для приготовления мазка для подсчета лейкоцитов, оставшуюся часть центрифугировали, надосадочную жидкость отбирали и использовали для исследований.
Проведенные исследования.
1. В слезной жидкости кроликов определяли активность СОД.
2. Во влаге передней камеры определяли:
концентрацию общего белка по Лоури [28];
антиокислительную активность в отношении гидроксильного радикала (АОА-ОН•) [34];
уровень 2-макроглобулина (2-МГ) [36].
3. Проводили подсчет лейкоцитов в водянистой влаге.
Хемилюминесцентный метод определения антиокислительной активности водянистой влаги передней камеры глаза.
В работе использован хемилюминесцентный метод определения антиокислительной активности биологического материала в модельной системе гемоглобин-люминол-перекись водорода, разработанный на кафедре биофизики медико-биологического факультета РГМУ (зав.каф. академик РАМН проф. Ю.А.Владимиров) Владимировым Ю.А., Любицким О.Б., Клебановым Г.И., Теселкиным Ю.О., Бабенковой И.В [10,28,34,35].
Принцип метода.
Метод хемилюминесценции (ХЛ) относят к прямым методам изучения свободных радикалов и их реакций [7].
Процесс СРО модельной системы Нb-ЛМ-Н2О2 сопровождается испусканием квантов света хемилюминесценции. Зависимость интенсивности ХЛ от времени называют кинетикой ХЛ. Основными параметрами кинетики ХЛ являются: величина латентного периода (время от момента индукции СРО до начала развития свечения), светосумма (площадь под хемилюминесцентной кривой за время t), максимальная интенсивность ХЛ [7-9,23,24].
В работе для изучения антиокислительных свойств исследуемых веществ использована система гемоглобин-Н2О2-люминол, в которой в качестве субстрата окисления выступает люминол. Надо сказать, что люминол одновременно является как активатором хемилюминесценции, дающим мощное свечение в присутствии радикалов гидроксила [7], так и непосредственным участником химических реакций [9].
Молекула люминола (5-амино-1,2,3,4-тетрагидро-фталазин-1,4-дион) имеет следующую структуру:

В водных растворах при рН, близких к нейтральным, люминол существует в виде смеси двух таутомерных форм:

|
которые могут подвергаться ионизации:

|
При взаимодействии с активными формами кислорода (АФК) люминол подвергается свободнорадикальному окислению (СРО), в ходе которого испускаются кванты ХЛ [28,34,35].
В настоящей работе для инициирования СРО люминола использована смесь гемоглобина и Н2О2. В процессе их взаимодействия образуются радикалы-инициаторы окисления люминола, в качестве которых выступают феррил-радикалы гемоглобина и ОН*.
Далее последовательность реакций выглядит следующим образом:
Х• + LH- ХН + L-• , (1)
(Х. - феррил радикал гемоглобина или ОН., L-.- семихинон радикал люминола)
.
L-• + O2 L + О2-•, (2)
О2-• + L-• LO22- , (3)
(LO22- - эндопероксид люминола)
Эндопероксид люминола является нестабильным соединением и легко разрушается. В результате его разрушения выделяется азот (N2) и образуется 3-аминофталат дианион в возбужденном состоянии (АфО22-)* (р-я 4). Последний переходит в основное состояние с испусканием квантов света ХЛ в видимой области спектра (р-я 5) [28].
LO22- N2 + (АфO22-)• , (4)
(АфO22- - 3-аминофталат дианион)
(АфO22-)• АфO22- + hn (lmax=425 нм) (5)
Введение в модельную систему антиоксидантов приводит к торможению СРО люминола. Это проявляется в изменении параметров кинетики ХЛ: увеличении латентного периода, уменьшении светосуммы и интенсивности свечения. Характер изменения указанных параметров зависит от механизма антиокислительного действия исследуемого вещества. Так, например, показано, что антиоксиданты, взаимодействующие с феррил-радикалами гемоглобина и ОН.*, заметно удлиняют латентный период, почти не влияя на интенсивность ХЛ, тогда как антиоксиданты, перехватывающие радикалы люминола и О2-•, понижают интенсивность ХЛ, не изменяя латентного периода [7,28,34].
Построение калибровочной кривой.
Для построения калибровочной кривой используют тролокс (6-hydroxy-2,5,7,8,-tetramethyl-chroman), который представляет собой водорастворимый аналог витамина Е. Из основного 0,256 мМ р-ра тролокса готовят 4, 8, 16 мкМ растворы, которые используют для построения калибровочной кривой.
Для построения калибровочной кривой на оси абсцисс откладывают значение концентрации, а на оси ординат величину ( t – t 0)/ t0, где t0 - латентный период ХЛ или время, прошедшее от момента внесения Н2О2 в реакционную среду контрольной пробы до начала развития свечения ХЛ. Латентный период t0 определяется путем аппроксимирования прямолинейного участка кривой хемилюминесценции и ее экстраполяцией на ось абсцисс (Рис.6.6.1); t - время, прошедшее от момента внесения Н2О2 в реакционную среду опытной пробы до начала развития свечения хемилюминесценции (определяется аналогично t0) (Рис.6.6.2).
Рис.6.6.1 Зависимость интенсивности ХЛ от времени в контрольной пробе.
по оси абсцисс время в секундах
по оси ординат интенсивность ХЛ в относительных единицах

Рис.6.6.2. Зависимость интенсивности ХЛ от времени в присутствии тролокса в концентрации 8 мкМ.
по оси абсцисс время в секундах
по оси ординат интенсивность ХЛ в относительных единицах

|
Внесение тролокса (антиоксидант) в пробу приводит к увеличению латентного периода кинетической кривой, при этом линейная зависимость между концентрацией тролокса и длительностью латентного периода сохраняется в области от 4мкМ до 16 мкМ тролокса (Рис.6.6.3), что позволяет использовать его в качестве калибратора в данной модельной системе.
Рис.6.6.3. Зависимость параметра (t-t0)/t0 от концентрации тролокса.

Калибровка по тролоксу и расчет антиоксидантной активности образца производятся автоматически при помощи программного обеспечения прибора "Биотокс-7".
Реактивы.
1. 0,05 М фосфатный буфер, рН =7,4, содержащий 0,1 мМ ЭДТА (Sigma-Aldrich);
2. 5,0 мМ раствор гемоглобина (ICN Biomedicals Inc.) в 0,05 М фосфатном буфере рН=7,4 (готовится ex tempore);
3. 1 мМ раствор люминола в фосфатном буфере (основной раствор)
Хранится в пробирках эппендорф замороженном виде при -18°С. Рабочий раствор готовится в день проведения исследования путем разведения основного раствора в 10 раз 0,5 М фосфатным буфером
4. 33% пергидроль - основной раствор. Рабочий реактив (0,98 мМ Н2О2 ) готовится в день проведения исследования путем разведения основного раствора в 10000 раз бидистиллированной водой.
5. 0,256мМ раствор тролокса (6-hydroxy-2,5,7,8,-tetramethyl-chroman) (Sigma-Aldrich) - основной раствор на фосфатном буфере. Хранится в пробирках эппендорф замороженном виде при -18°С. Для построения калибровочной кривой используются 4, 8 и 16 мкМ концентрации тролокса, которые готовятся в день проведения исследования последовательным разведением основного раствора 0,5М фосфатным буфером.
Ход определения.
Контрольная проба: в пробирку эппендорф вносят 370 мкл фосфатного буфера и добавляют 50 мкл люминола и 50 мкл гемоглобина. Тщательно перемешивают. Для инициирования реакции СРО люминола добавляют 30 мкл рабочего раствора пероксида, перемешивают и точно фиксируют время внесения реактива. Пробирку помещают в хемилюминометр “Биотокс-7”, который регистрирует кинетику свободнорадикальной реакции в модельной системе. Прибор "Биотокс-7" подключен к компьютеру. Измерения производятся 1 раз в секунду, кинетическая кривая отображается на экране, программное обеспечение позволяет автоматически строить калибровочную кривую и рассчитывать величину АОА.
Опытная проба: в пробирку эппендорф вносят 340 мкл фосфатного буфера и добавляют последовательно 50 мкл люминола, 50 мкл гемоглобина и 30 мкл биологического материала или раствор тролокса (для калибровки). Тщательно перемешивают. Вносят 30 мкл рабочего раствора Н2О2, фиксируют время, перемешивают и регистрируют кинетику СРО на хемилюминометре (Табл.№ 6.6.1).
Таблица № 6.6.1. Схема анализа.
| проба реактивы | контроль | тролокс | опыт |
| буфер, мкл | |||
| люминол, мкл | |||
| гемоглобин, мкл | |||
| тролокс, мкл | - | - | |
| исслед. материал, мкл | - | - | |
| перемешать | |||
| перекись водорода, мкл | |||
| перемешать |
6.7.Определение активности СОД по автоокислению кверцетина.
В работе использован спектрофотометрический метод определения активности супероксиддисмутазы в биологическом материале в модельной системе автоокисления кверцетина [22], модифицированный для определения активности СОД в слезной жидкости.
Принцип метода.
Прямое определение активности фермента требует весьма сложного оборудования, отсутствующего в большинстве биохимических лабораториях и медицинских учреждениях. Вместе с тем активность СОД является одним из наиболее часто определяемых показателей в различных экспериментальных и клинических исследованиях. В связи с чем и был разработан этот метод.
Окисление кверцетина в 0,015 М фосфатном буфере при нейтральном и слабощелочном рН ингибируется ЭДТА и ускоряется при добавлении ионов двухвалентного железа. Роль О2-. в этом процессе, по-видимому, незначительна поскольку СОД не ингибирует окисление кверцетина (результаты не приводятся). Добавление в инкубационную среду ТМЭДА сдвигает рН раствора до 10,0. В этих условиях интенсивное окисление кверцетина, сопровождаемое разрушением хромофора с максимумом поглощения при 406 нм и увеличением поглощения при 335нм, протекает в присутствии 0,08 мМ ЭДТА (Рис.6.7.1).
Рис. №6.7.1. Динамика спектральных изменений, отражающая процесс аутоокисления кверцетина при рН 10,0 в присутствии ТМЭДА (0,8мМ) и ЭДТА (0,08мМ).
1-спектр поглощения неокисленного кверцетина (1,4*10-5 М); 2-5 – спектры поглощения кверцетина после 5,10,15 и 20 мин окисления соответственно.

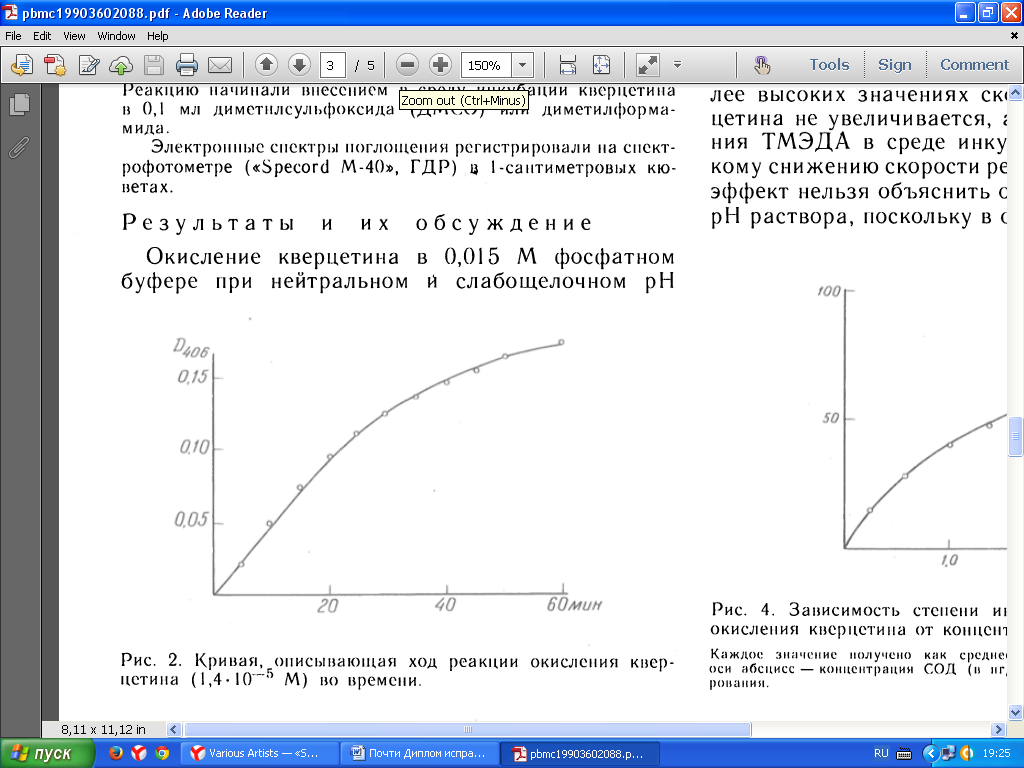
При этом между количеством окисленного кверцетина, оцениваемого по величине оптической плотности при 406 нм, и длительностью реакции сохраняется в течение первых 20 мин линейная зависимость (Рис. №6.7.2).
Рис. №6.7.2. Кривая, описывающая ход реакции окисления кверцетина (1,4*10-5 М) во времени.
Реактивы:
1. 0,02 М фосфатный буфер, содержащий 0,08мМ ЭДТА, рН 10,2
2. Тетраметилэтилендиамин (ТМЭДА, ТЕМЕД) (Helicon, Россия):
к 160 мл фосфатного буфера добавить 200 мкл ТЕМЕД (ex tempora), выдержать 2 часа при комнатной температуре
3. Кверцетин (Диаэм, Россия):
1,5 мг растворить в 10 мл ДМСО (ex tempora)
Буфер, смешанный с ТЕМЕД можно использовать в течение одного рабочего дня.
Ход определения.
Контрольная проба: в микрокювету вносят 930 мкл буфера и 30 мкл кверцетина, быстро перемешивают многократным пипетированием, сразу же измеряют абсорбцию в кювете при 406 нм против воды. Инкубируют при комнатной температуре в течение 20 мин., точно после истечения 20 мин снова измеряют величину абсорбции. Для более точных результатов используют измерения нескольких контрольных проб, вычисляют среднее значение.
Опытная проба: в микрокювету вносят 900 мкл буфера, 30 мкл элюата, 30 мкл кверцетина, быстро перемешивают многократным пипетированием, измеряют абсорбцию в кювете при 406 нм, инкубируют в течении 20 мин, точно после истечения 20 мин снова измеряют величину абсорбции.
Измерения оптической плотности проводили на спектрофотометре Shimadzu UV-160A (Япония).
Расчет активности СОД.
Присутствие СОД тормозит автоокисление кверцетина, поэтому через 20 мин абсорбция в образцах оказывается меньше, чем в контроле. Вычислив разность между абсорбцией при первом и втором измерениях, сравнивают ее с таковой в контроле и рассчитывают % ингибирования по сравнению с контролем. Затем по калибровочной кривой определяют активность СОД.
Калибровочную кривую строили по Cu,Zn-CОД человека (препарат "Рексод", ООО "НПП Ферментные технологии", Россия)
6.8.Измерение активности a2-макроглобулина в исследуемом материале.
Для определения активности a2-МГ во влаге передней камеры использовали метод К.Н. Веремеенко и Л.И. Волохонской в модификации Т.А. Кримштейн и В.Б. Хватова, модифицированный для микроанализа [36].
Принцип метода.
Белки семейства макроглобулинов играют весьма существенную роль в развитии воспалительной реакции, контролируя, прямо, либо посредством связывания и транспортировки различных регуляторных лигандов, практически все ключевые моменты ответа организма на внешние, либо внутренние патогенны [15].
Определение активности a2-МГ основано на том, что комплекс a2-МГ-трипсин сохраняет протеолитическую активность по отношению к низкомолекулярным субстратам, и на эту активность не влияет ингибитор трипсина из бобов сои.
Молекула a2-макроглобулина необратимо ингибирует участок связывания трипсина с высокомолекулярными субстратами, оставляя при этом открытым участок связывания с низкомолекулярными веществами. В результате при таком взаимодействии образуется комплекс (a2-МГ-трипсин) с активным участком на трипсине. Добавление к такому комплексу низкомолекулярных хромогенных субстратов (БАПНА), позволяет судить об уровне a2-макроглобулина в исследуемом материале по накоплению окрашенного продукта реакции (пропорционален изменению окраски образца).
Коэффициенты в формуле для расчета активности a2-макроглобулина в слезе и влаге передней камеры были определены при помощи калибровочной кривой, построенной по стандартному раствору р-нитроанилина.
Реактивы:
1. 0,2М Трис-HCl буфер, рН 7,4
2. 4% раствор трипсина в 0,001Н HCl
3. Ингибитор трипсина из бобов сои 0,005% раствор в Трис-HCl буфере
4. БАПНА (Na-бензоил-DL-аргинин-p-нитроанилид) 0,06% раствор в Трис-HCl буфере
5. 0,001Н HCl
Растворы трипсина, ингибитора и БАПНА использовать в день приготовления, буфер хранить в холодильнике.
Биологический материал можно хранить в холодильнике, не замораживая, не более 3 суток.
Ход определения.
Контрольная проба: В лунки 96-луночного планшета вносят по 40 мкл физиологического раствора. К нему добавляют 50 мкл Трис-HCl буфера. Инкубируют при комнатной температуре на 15 мин. После добавляют 100 мкл раствора БАПНА и 10 мкл раствора соевого ингибитора в Трис-HCl буфере, инкубируют при 37°С 30 мин при перемешивании в шейкере-инкубаторе. Реакцию останавливают, внося в лунки по 25 мкл НСl. Затем в лунки вносят 50 мкл раствора трипсина.
Опытная проба: В лунки 96-луночного планшета вносят по 40 мкл исследуемого материала. К нему добавляют 50 мкл Трис-HCl буфера, 50 мкл 4% раствора трипсина в 0,001Н НСl,. Инкубируют при комнатной температуре на 15 мин. После добавляют 100 мкл раствора БАПНА, 10 мкл раствора соевого ингибитора в Трис-HCl буфере и инкубируют при 37°С 30 мин при перемешивании в шейкере-инкубаторе. Реакцию останавливают внося в лунки по 25 мкл НСl. Регистрируют оптическую плотность при длине волны 410 нм.
Оптическую плотность образцов регистрировали с помощью многофункционального фотометра для микропланшет Synergy MX (BioTek, USA).
Таблица №.6.8. 1. Схема анализа.
| проба реактивы | Опытная проба | Контрольная проба |
| Слеза, мкл | ||
| Физиологический раствор, мкл | ||
| Буфер, мкл | ||
| Трипсин, мкл | ||
| Инкубировать 15 мин при комн. температуре | ||
| Ингибитор, мкл | ||
| БАПНА | ||
| Инкубировать 30 мин при 37 С | ||
| 0,5Н НСl, мкл | ||
| Трипсин, мкл |
Расчет активности a2-МГ в слезной жидкости:
(D - Dk) •0,108 = А (нмоль/мин•мл)
удельная активность = А/(m•0,04), где
А - активность фермента
D - оптическая плотность образцов слезы, измеренная при 410 нм.
Dk - оптическая плотность контрольных образцов
m – содержание белка в пробе в мг/мл
0,108- коэффициент, рассчитанный с помощью калибровочной кривой, построенной по р-нитроанилину.
6.9.Определение количества лейкоцитов во влаге передней камеры.
Количество лейкоцитов во влаге передней камеры отображает интенсивность воспалительной реакции при увеите.
Количество лейкоцитов во влаге передней камеры подсчитывали под световым микроскопом в неокрашенном мазке, приготовленном из 20 мкл влаги передней камеры сразу после ее отбора. Определяли среднее количество лейкоцитов в поле зрения после подсчета в пяти полях зрения.
6.10.Статистическая обработка данных.
Статистическая обработка результатов проведена с использованием статистического пакета программ "Excel" и Statistica 6.0. Исследуемые выборки были подвергнуты тесту на нормальность распределения. Показатели с нормальным распределением представлены как среднее значение (М) и стандартная ошибка среднего арифметического отклонение (m), достоверность различий между группами, с уровнем значимости не менее 95% оценена с помощью параметрического t–критерия Стьюдента.
В таблицах для выраженности клинических признаков ожоговой болезни представлены значения выборочного среднего с указанием доверительного интервала, покрывающего это значение с надежностью 0,95. Поскольку данные показатели являются дискретными, для оценки различий между группами применен непараметрический U-критерий Манна-Уитни.
Дата добавления: 2015-04-19; просмотров: 1927;
