ПАТОФИЗИОЛОГИЧЕСКИЕ
МЕХАНИЗМЫ КАРДИОГЕННОГО
ШОКА
| Острый инфаркт миокарда: потеря массы левого желудочка до критического уровня; правожелудочковая недостаточность. |
| ... .. ψ |
| Механические осложнения: острая митральная регургитация, обусловленная разрывом или дисфункцией папиллярных мышц; разрыв межжелудочковой перегородки; разрыв стенки левого желудочка; аневризма левого желудочка. |
| t |
| Другие условия: последняя стадия кардиомиопатии; ушиб миокарда; острый миокардит; аортальный стеноз; обструктивная гипертрофическая кардиомиопатия; митральный стеноз; миксома или тромбоз предсердия; осложнения искусственного кровообращения. |
Клиническая картина типична: заостренные черты лица, серовато-бледные, иногда с циано-тичным оттенком, холодные, покрытые липким потом, кожные покровы; адинамия; больной почти не реагирует на окружающее. Пульс частый, нитевидный, иногда не прощупывается. АД нередко ниже
80 мм рт.ст., но у больных с исходной артериальной гипертензией симптомы шока могут появляться и при нормальных цифрах систолического АД (95—120 мм рт.ст.). Пульсовое давление 20—25 мм рт.ст. и ниже. Характерным симптомом, опасным в прогностическом отношении, является олигурия (анурия) до 20 мл в час и менее. К признакам шока относят метаболический ацидоз.
Исходя из особенностей возникновения шока, его клинической картины и эффективности лечения, выделяют следующие его формы: рефлекторный, истинный кардио-генный, ареактивный, аритмический [Чазов Е.И., 1992].
Рефлекторный шок.Развитие этой формы шока обусловлено рефлекторными изменениями и выраженным болевым синдромом, вызывающими нарушение регуляции сосудистого тонуса с последующим депонированием крови в сосудах и выход жидкой фракции крови в ин-терстициальное пространство, что приводит к уменьшению венозного притока к сердцу. Вследствие патологических рефлекторных влияний, особенно при инфаркте миокарда задней стенки, может развиться синусовая брадикардия — значительное сокращение MOC, снижение АД (до 90—100 мм рт.ст.), уменьшение опсс.
У больных с этой формой шока достаточный и быстрый эффект достигается адекватным обезболиванием и введением сосудистых средств (симпатомиметиков). Для обезболивания применяют наркотические анальгетики и препараты для нейролептаналгезии. Из симпатомиметиков чаще всего используют 1 % раствор мезатона (0,3—1 мл) или 0,2 % раствор норадреналина (2—4 мл) внутривенно капельно на изотоническом растворе натрия хлорида или 5 % растворе глюкозы методом титрования или вводят 25 мг допамина в 125 мл изотонического раствора натрия хлорида. При бра-
дикардии показано внутривенное введение 0,5—1 мл 0,1 % раствора атропина. Чтобы увеличить приток крови к сердцу, следует приподнять ноги больного на 15—20°. Проводят оксигенотерапию через носовой катетер или маску [Браунвальд E., 1995; Фомина И.Г., 1997].
Для повышения ОЦК, притока крови к сердцу, давления наполнения левого желудочка, CB и ликвидации артериальной гипотензии показано введение кровезаменителей. Предпочтительно использование реополиглюкина (200—400 мл со скоростью 20 мл/мин). Он улучшает реологические свойства крови и микроциркуляцию. Показана тром-болитическая терапия.
Истинный кардиогенный шок.В развитии этой формы шока основное значение приобретает резкое падение пропульсивной (сократительной) функции левого желудочка. Уменьшение MOC не компенсируется повышением ОПСС, что приводит к снижению АД. Систолическое АД ниже 90 мм рт.ст., у больных с артериальной гипертензией ниже 100 мм рт.ст.; пульсовое давление меньше 20 мм рт.ст. Возникают глубокие нарушения кровообращения во всех органах и тканях, развиваются олигурия, анурия.
При этой форме КШ уже в первые часы от начала инфаркта миокарда проводят обезболивающую и тромболитическую терапию, применяют лекарственные препараты, оказывающие положительное ино-тропное действие (в первую очередь катехоламины). Норадреналин в малых дозах оказывает преимущественно инотропное, а в высоких дозах — сосудосуживающее действие на миокард. Вводят препарат внутривенно капельно по 1—2 мг (0,5— 1 мл 0,2 % раствора) в 200 мл изотонического раствора натрия хлорида или 5 % раствора глюкозы. Скорость введения регулируется в зависимости от уровня АД (среднее АД 80—90 мм рт.ст.) и ритма сердца. АД
не должно быть выше 110—115 мм рт.ст. (у больных с предшествующей стойкой и высокой гипертензией — 130—140 мм рт.ст.). Средние дозы норадреналина от 4 до 16 мкг/мин. Показанием к его применению является KIII с низким ОПСС [Фомина H. Г., 1997].
При KUI эффективен также допа-мин, оказывающий положительное инотропное действие и уменьшающий сопротивление коронарных, мозговых, почечных, мезентериаль-ных сосудов. Вводят его внутривенно капельно со скоростью 2— 10 мкг/кг/мин под мониторным контролем, так как он может вызвать аритмию. Допамин разводят из расчета 25 мг на 125 мл или 200 мг на 400 мл 5 % раствора глюкозы или изотонического раствора натрия хлорида, т.е. в 1 мл последнего должно быть 200 или 500 мкг допа-мина. Начальная скорость введения 1—5 мкг/кг/мин (-200 мкг/мин).
У больных с не очень выраженной степенью гипотензии может оказаться полезным добутамин, который является синтетическим сим-патомиметическим амином, оказывающим в обычных дозах (2,5— 10 мкг/кг/мин) минимальное положительное инотропное и периферическое сосудосуживающее действие. Его не следует использовать в тех случаях, когда желательно добиться сосудосуживающего эффекта, и необходимо применять тогда, когда нежелательно положительное хро-нотропное действие (мало влияет на ЧСС). Начальная скорость внутривенного введения 2,5 мкг/кг/мин, вводят препарат каждые 15—30 мин, максимальная скорость инфузии 10—15 мкг/кг/мин [Браунвальд E., 1995].
Сердечные гликозиды при КШ у больных с инфарктом миокарда малоэффективны. Не оправдано и применение кортикостероидов.
При безуспешности медикаментозной терапии «истинного» КШ необходимо проводить контрпуль-
сацию. Важный метод лечения этого вида шока — восстановление крово-тока по окклюзированной венечной артерии (тромболизис, транслюми-нальная ангиопластика).
Ареактивный шок.О наличии этой формы шока говорят в тех случаях, когда введение возрастающих доз норадреналина или гипертензи-на в течение 15—20 мин не ведет к повышению АД. В настоящее время не удается достаточно эффективно лечить больных в шоковом состоянии, что обусловливает их высокую смертность.
Аритмический шок.В этих случаях отмечается четкая связь падения АД и появления периферических симптомов шока с нарушениями ритма и проводимости. При восстановлении сердечного ритма, как правило, исчезают и признаки шока. Первостепенная задача лечения — восстановление нормальной частоты желудочковых сокращений.
В остром периоде инфаркта миокарда аритмии возникают практически у каждого больного. Для профилактики желудочковых аритмий наиболее эффективен лидокаин. Вводят его внутривенно в первоначальной дозе 100—120 мг (5—6 мл 2 % раствора), а затем внутривенно капельно со средней скоростью 2— 4 мг/мин. При необходимости показано повторное струйное введение 60—100 мг лидокаина. Эту же дозу вводят при рецидиве экстрасисто-лии. Некоторые авторы указывают на прямое антигипоксическое действие лидокаина путем стабилизации клеточных мембран кардиоци-тов. Лидокаин оказывает очень слабое отрицательное инотропное влияние, при этом АД и CB существенно не меняются. Суточная доза препарата не более 2—3 г (у больных старше 70 лет при КШ, недостаточности кровообращения и нарушениях функции печени дозу уменьшают вдвое) [Сыркин А.Л., 1991].
При неэффективности лидокаина можно применить новокаинамид до
1 г под контролем ЭКГ и АД после каждых 100 мг (1 мл 10 % раствора) или блокаторы β-адренорецепторов (индерал из расчета 1 мг на 10 кг массы тела) внутривенно.
В последнее время считают, что лечение аритмий лучше начинать с быстрого определения и коррекции электролитных нарушений — гипо-калиемии и гипомагнезиемии. При гипокалиемии (уровень K+ менее 3,5 ммоль/л) 10 ммоль калия хлорида растворяют в 50—100 мл раствора глюкозы и вводят внутривенно ка-пельно в течение 30 мин. Введение этой дозы повторяется каждый час до достижения уровня K+ в плазме 4—4,5 ммоль/л. Меньшая степень гипокалиемии может быть скорри-гирована с помощью оральной терапии.
При гипомагнезиемии (уровень Mg2+ в плазме крови менее 0,7 ммоль/л) 1—2 г магния сульфата разводят в 50—100 мл изотонического раствора натрия хлорида и вводят в течение 50—60 мин, затем — от 0,5 до 1 г каждый час до 24 ч. Скорость и продолжительность инфузии зависят от клинической картины или степени магнезиемии. Введение раствора магния сульфата безопасно и сокращает частоту желудочковых аритмий [Браунвальд E., 1995; Knobel E., 1999].
Новый метод антиаритмической защиты миокарда при инфаркте миокарда — внутривенное лазерное облучение крови гелий-неоновым лазером. Его применяют в остром периоде заболевания. Лазерное облучение крови создает анальгети-ческий эффект, уменьшает число желудочковых экстрасистол более чем на 90 % и приводит к быстрой положительной динамике на ЭКГ [Быстрое В.И., Бутров А.В. и др., 1995].
Аритмии, наиболее опасные для жизни больного. Желудочковая тахикардия(рис. 24.1), которая может перейти в ФЖ. При длительной ЖТ применяют препараты, дающие
мембранный эффект. Препаратом выбора является лидокаин с последующей его комбинацией с пропра-нололом или проксинамидом. Если аритмия сохраняется и имеются нарушения гемодинамики, то проводят электроимпульсную терапию (дефибрилляцию).
Фибрилляция (мерцание) желудочков(рис. 24.2). Для прекращения фибрилляции проводят немедленную электродефибрилляцию. Для обеспечения хорошей оксигенации и перфузии миокарда необходима адекватная вентиляция кислородом. Кардиоверсию проводят постоянным током, начиная с 50 Дж, при отсутствии эффекта увеличивают разряд каждый раз на 50 Дж.
Желудочковые экстрасистолиимогут угрожать жизни больного, так как способны переходить в мерцание и трепетание желудочков. Существует большая опасность развития ЖТ и ФЖ при выявлении одного или нескольких критериев:
1) частота желудочковых экстрасистол 6 и более в 1 мин (рис. 24.3);
2) политопные экстрасистолы (рис. 24.4);
3) групповые желудочковые экстрасистолы (рис. 24.5; 24.6; 24.7);
4) ранние желудочковые экстрасистолы типа «R» на «Т» (рис. 24.8).
Внутривенное введение лидокаина является методом выбора при желудочковых экстрасистолиях и аритмиях. Препарат начинает действовать быстро, и так же быстро исчезают его эффекты (в течение 15—20 мин после введения). Для быстрого достижения эффекта препарат вводят внутривенно болюсно из расчета 1 мг/кг. Для поддержания эффекта проводят постоянную инфузию лидокаина из расчета 2—4 мг/мин. Если аритмия сохраняется, то через 10 мин после введения первого болюса вводят второй в дозе 0,5 мг/кг. При застойной сердечной недостаточности дозу лидокаина уменьшают вдвое. Эффект наступает через 72—96 ч. Общая доза лидокаина до
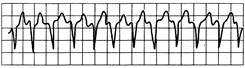
Рис. 24.1.Желудочковая тахикардия.
Зубцы P не выявляются, комплексы QRS имеют патологическую форму.
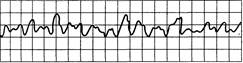
Рис. 24.2.Мерцание (фибрилляция) желудочков. Синусоида нерегулярная, неритмичная, комплексы QRST отсутствуют, частота волн мерцания более 250 в
минуту.
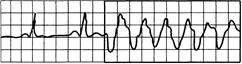
Рис. 24.3.Три и более (обычно до 9) последовательных желудочковых экстрасистол.
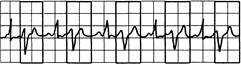
Рис. 24.4.Бигемения: каждый синусовый импульс сопровождается преждевременным желудочковым комплексом (экстрасистолой).
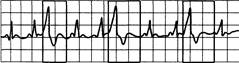
Рис.24.5. Тригемения: за каждыми двумя синусовыми сокращениями следует экстрасистола.
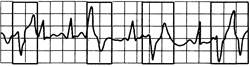
Рис. 24.6.Мультиформные желудочковые экстрасистолы. Морфологически различные преждевременные желудочковые комплексы (экстрасистолы).
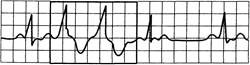
Рис.24.7. Спаренные желудочковые экстрасистолы.
Две последовательные экстрасистолы за синусовым ритмом.
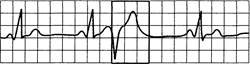
Рис. 24.8.Желудочковая экстрасистолия типа «R» на «Т».
Комплекс QRS экстрасистолы наслаивается на вершину или нисходящее колено предшествующего зубца T.
2000 мг/сут [Фрид M., Грайнс С., 1996; Marini JJ., Wheeler A.P., 1997]. Синусовая брадикардия.Мнения о значении брадикардии как фактора, предрасполагающего к развитию ФЖ, противоречивы. Синусовая брадикардия, возникающая в первые часы острого инфаркта миокарда, может привести в последующем в отличие от брадикардии, возникающей в более поздние сроки острого инфаркта миокарда, к появлению эктопических желудочковых ритмов. Лечение синусовой брадикардии показано в тех случаях, когда она вызывает нарушения гемо-динамики или когда на ее фоне развивается выраженная эктопическая
активность желудочков. Для ускорения синусового ритма используют атропин (внутривенно в дозе 0,4— 0,6 мг). Если пульс менее 60 в минуту, возможно повторное введение атропина по 0,2 мг до тех пор, пока общая доза не составит 2 мг. Но нужно помнить, что атропин может усугублять ишемию или вызывать ЖТ или ФЖ. При стойкой бради-кардии (менее 40 в минуту), латентной к введению атропина, требуется проведение электрической стимуляции сердца. Временная терапия чрескожной или чреспищеводной кардиостимуляцией, инфузией до-памина или эпинефрина может быть необходима при слишком медленном сердечном ритме для поддержания адекватного CB. Наиболее эффективна у таких больных трансвенозная электрокардиостиму-ляция.
Нарушения проводимостивстречаются при инфаркте миокарда довольно часто, особенно в 1—2-й день болезни. Они могут возникать на различных уровнях проводящей системы сердца: в области предсердно-желудочкового узла, предсердно-же-лудочкового пучка (пучок Гиса) или в более дистальных отделах проводящей системы. Ишемия предсердно-желудочкового узла обычно встречается при инфаркте миокарда правого желудочка, потому что данный узел кровоснабжается правой коронарной артерией. Это может привести к атриовентрикулярной блокаде разной степени, вплоть до полной, ре-зистентной к атропину. В подобной ситуации необходима последовательная атриовентрикулярная электростимуляция, в то время как электростимуляции желудочка следует избегать из-за отсутствия эффекта и возможного вреда.
Наиболее опасные нарушения проводимости сердца:
• блокада сердца II степени(промежуточная атриовентрикулярная блокада) возникает в том случае,
когда часть импульсов не достигает желудочков. АВ-блокада типа Мобиц-I (АВ-блокада Венкебаха) (рис. 24.9) является следствием нарушения проводимости на уровне предсердно-желудочкового узла. В редких случаях блокада Mo-биц-I может прогрессировать до полной блокады сердца. АВ-блокада типа Мобиц-П (рис. 24.10) имеет тенденцию к прогрессиро-ванию вплоть до полной блокады сердца. Подчиненный водитель ритма, включающийся в нижних отделах системы Гиса—Пуркинье вследствие ускользания, обладает нестабильным, медленным ритмом. Прогноз часто неблагоприятный. В этом случае показана имплантация кардиостимулятора;
• АВ-блокадп III степени(рис. 24.11) происходит в случаях, когда ни один предсердный импульс не поступает к желудочкам. Полная АВ-блокада представляет значительную опасность для жизни больного. Клинически может проявляться аритмогенным шоком или приступами Морганьи— Адамса—Стокса, одним из проявлений которого является потеря сознания. Приступы чаще всего возникают в результате длинной предавтоматической паузы при переходе от неполной АВ-блока-ды к полной. Происходит резкое замедление деятельности сердца до полной его остановки, наступает гипоксия мозга или появляются групповые политопные экстрасистолы с переходом в трепетание и мерцание желудочков. При АВ-блокаде III степени наиболее эффективна трансвенозная эл ектрокардиостимуляция;
• пароксизмальная и предсердная тахикардия, трепетание и мерцание предсердий(рис. 24.12) при инфаркте миокарда встречаются редко. При мерцании (фибрилля-ции) предсердий могут возникать заметные расстройства гемодина-мики, обмороки, сердечная недо-
статочность. При нестабильной гемодинамике показано устранение мерцания и трепетания предсердий срочной кардиоверсией или электростимуляцией предсердий с частотой, превышающей частоту трепетания предсердий. Кардиоверсию проводят одиночным импульсом постоянного тока (заряд 200 Дж или менее).
Лечение. Цель лечения — поддержание CB на уровне, обеспечивающем основные потребности организма, и снижение риска потерь ишеми-зированного миокарда.
Условно лечение КШ можно разделить на:
• основные поддерживающие мероприятия (обезболивание; искусственная оксигенация и/или вентиляция; седатация; устранение аритмий, метаболического ацидоза и/или гиповолемии);
t фармакотерапию (инотропные и вазопрессорные средства, вазоди-лататоры, диуретики, ацетилса-лициловая кислота, гепариниза-ция);
• механическую поддержку кровообращения (электрокардиостиму-ляция, внутриаортальная баллонная контрпульсация, при неэффективности последнего — вспомогательные устройства, замещающие сниженную функцию желудочка — центробежные насосы, искусственное кровообращение и искусственные желудочки);
• реперфузию коронарных артерий (тромболизис, механическая ре-перфузия — чрескожная транслю-минальная коронарная ангио-пластика);
• оперативные вмешательства (хирургическая реваскуляризация миокарда).
Несмотря на такие значительные достижения в лечении заболеваний сердца, как тромболитическая терапия, методы частичного или полного искусственного кровообращения и
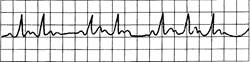
Рис. 24.9.АВ-блокада II степени (Вен-кебаха, Мобиц-1).
Постоянное удлинение интервала P-Q с выпадением комплекса QRST, интервалы R-R прогрессивно укорачиваются; P-P относительно постоянны.

Рис. 24.10.АВ-блокада II степени (Мобиц-П). Интервалы P-Q постоянные, могут быть удлиненными; выпадение желудочковых комплексов QRST, длинные паузы равны удвоенному интервалу P-P; P. QRS= 3:2; 4:3; 5:4 и т.д.
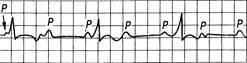
Рис. 24.11.АВ-блокада III степени (полная).
Интервалы R-R и P-P постоянные. Частота P больше частоты комплексов QRS; комплексы QRS нормальной продолжительности или расширены и деформированы.
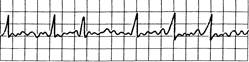
Рис. 24.12.Мерцание (фибрилляция) предсердий. Отсутствие четких зубцов P9 комплексы QRS неправильной формы, частоты и вольтажа. Частота сокращения предсердий около 350 и более в минуту.
трансплантация сердца, летальность при КШ остается очень высокой — от 30 до 90 % [Knobel E., 1999].
Дата добавления: 2015-03-09; просмотров: 1066;
