Понятие о люминесценции
Поглощение атомом энергии светового кванта не проявляется в изменении скорости атома как целого, но вызывает изменение в распределении электрических зарядов внутри него.
Согласно современной теории атом состоит из положительного ядра и облака электронов, общий заряд электронов, общий заряд которых в сумме равен заряду ядра. Таким образом, в целом атом нейтрален. Число электронов изменяется в зависимости от сложности атома и равно атомному номеру элемента в периодической системе Менделеева. Простейший атом ― атом водорода ― имеет только один электрон, сложные атомы могут иметь несколько десятков электронов. В этом случае электроны разделяются на слои, расположенные вокруг ядра. Слои распадаются на несколько электронных оболочек. Для того чтобы оболочка была устойчива, она должна состоять из определенного количества электронов.
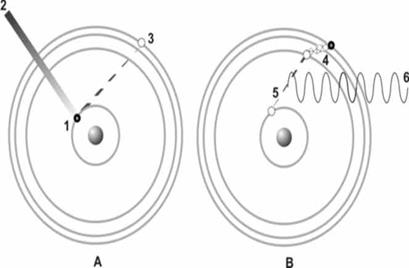
Рис.2.4.
На рис.2.4. показано как возникает люминесценция: на первом этапе (А) электрон (1) поглощает квант ультрафиолетового излучения (2), что переводит его на более высокий уровень энергии (3); затем (В), передав часть энергии кристаллу в виде тепла (4), электрон возвращается на исходный уровень (5), излучая остатки избыточной энергии в окружающее пространство в воде квантов света (6).
При увеличении атомного номера элемента заполнение электронных оболочек и слоев происходило в строгой последовательности. У более тяжелых атомов порядок заполнения оболочек несколько нарушается. В некоторых случаях первые оболочки высоких слоев заполняются ранее высоких оболочек низких слоев.
Видимое излучение ― люминесценция ― может возникнуть при поглощении атомом ультрафиолетовых или видимых лучей или при иных процессах, изменяющих расположение периферических электронов. Поглощение света внешним электроном изменяет положение и форму внешнего электронного облака и переводит атом в новое состояние, называемое возбуждением.
При поглощении света молекулой энергия поглощенного кванта частично расходуется на изменение конфигурации ее электронного облака, частично идет на изменение энергии колебаний ядер молекулы и изменении энергии ее вращения.
Для явлений люминесценции очень важны, однако, не чистые жидкости и не кристаллы с безупречно правильной решеткой, представляющей строгое повторение одних и тех же элементов, а растворы и кристаллы с решеткой, искаженной посторонними примесями. Эти инородные частицы и служат теми особыми местами вещества, которые являются источниками или носителями люминесценции. Однако их индивидуальные свойства, и прежде всего спектры поглощения и излучения, сильно изменяются, так как в общей массе жидкости или в поле кристаллической решетки они находятся под сильнейшим действием электрических зарядов окруженных частиц.
Переход молекулы в электронное возбужденное состояние может происходить не только при столкновении с быстро колеблющимися частицами, получившими энергию в процессе общего направления тела, но и многими другими путями, которые для этой цели применяются чаще и с большим удобством. Так, возбуждение молекулы наступает при поглощении кванта видимого или ультрафиолетового света, при соударении с электронами и иными быстро движущимися заряженными частицами, а также в ряде других случаев.
Возбужденные частицы обычно очень быстро, за время, измеряемое миллиардными долями секунды, теряют свою избыточную энергию и переходят в основное не возбужденное состояние. Такой переход может совершиться безызлучательно, путем передачи энергии окружающим частицам в виде тепла, или с излучением, которое и называется люминесценцией.
Таким образом, люминесценция ― это свечение, молекул, ионов и других более сложных компонентов, возникающее в результате электронного перехода в этих частицах при их возвращении из возбужденного состояния в нормальное (невозбужденное) за время большее периода световых колебаний.
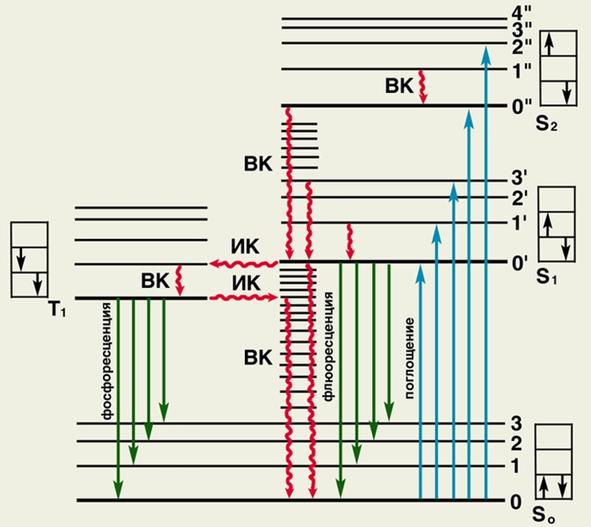
Рис.2.5.
На рис.2.5. показано схематическое изображение физического механизма люминесценции: жирными горизонтальными линиями обозначены энергетические состояния молекулы люминесцирующего вещества; S0 — основное (невозбужденное) состояние; S2, S2 и Т1 — возбужденные состояния; тонкими горизонтальными линиями обозначены колебательные уровни (0, 1, 2.,. или 0’, 1’, 2’ и т.д.); в прямоугольниках показано направление спина возбужденного электрона (слева) по отношению к спину оставшегося электрона; ВК — внутренняя конверсия (переходы электрона без обращения спина); ИК — интеркомбинационная конверсия (переходы электрона с обращением спина). При поглощении энергии молекула переходит в возбужденное состояние S1 или S2 (обозначено синими вертикальными стрелками). Часть поглощенной энергии преобразуется в тепло (обозначено волнистыми стрелками), при этом молекула переходит на нижний колебательный уровень состояния S1 или трансформируется в состояние Т1. Возвращение молекулы из состояния S1 или Т1 на исходный энергетический уровень может сопровождаться излучением света — флюоресценцией (обозначена темно-зелеными стрелками) или фосфоресценцией (обозначена светло-зелеными стрелками).
Характерные черты люминесценции.
В основание приведенного определения люминесценции положен характер элементарного процесса, протекающего в центре свечения. После излучения центр может оставаться в невозбужденном состоянии неопределенно долгое время, хотя не исключено, что он снова будет возбужден. В общем случае равновесия между внешним полем излучения и молекулами не предполагается, и тогда люминесценция является не равновесным процессом. Но в определенных частных случаях равновесие между состоянием поля излучения и молекулами может быть достигнуто, например, при равновесном температурном излучении, некоторые специфические свойства которого, связаны с его равновесным характером, нельзя распространять на все случаи люминесценции.
При исследовании люминесцентных явлений обычно наблюдается одновременное свечение огромного числа центров.
Поглощение энергии некоторое время остается в возбужденной люминесцентной частице. Это время определяется свойствами частицы и действиями внешней окружающей ее среды. Люминесценция вещества может характеризоваться длительностью возбужденного состояния, которое у частиц данного рода имеет вполне определенную среднюю величину, если они излучают в вакууме и не подвергаются действию окружающей среды.
Под действием внешнего поля и других частиц длительность возбужденного состояния может сократиться. Итак, люминесцентная частица является самостоятельным источником света, использующим поглощенную энергию, но преобразующим ее в собственное излучение. Эта важная особенность люминесценции отличает ее от несобственного излучения тела ― рассеяния и отражения веществом постороннего света.
Для возникновения свечения необходимо перевести частицы вещества в возбужденное состояние, т.е. ввести в них добавочный запас энергии, обеспечить для него условия достаточного длительного сохранения в молекуле, чтобы осуществился электронный переход и возращение центра в нормальное не возбужденное состояние. Последнее условие выполняется лишь в том случае, если возбужденные частицы обладают устойчивой конфигурацией электронного облака. Поэтому способность люминесцировать, присуща очень многим, но далеко не всем веществам.
В разряженном состоянии практически все газы обладают люминесцентной способностью и дают характерные спектры излучения в видимой и ультрафиолетовой области. Свечение чистых жидкостей обычно сильно потушено вследствие взаимодействия соседних частиц. Кроме того, у большинства органических веществ, но лежит в ультрафиолетовой области и недоступно непосредственному наблюдению глазом. Хорошо люминесцируют в видимой части спектра растворы многих солей: редкоземельных элементов, некоторых тяжелых металлов, ураниловых и платиносинеродистых соединений и т.д. Сильной люминесценцией обладают растворы многих органических соединений: ряда красителей, соединений ароматического рода и многих других органических соединений с сопряженными связями.
Перечисленные соединения хорошо люминесцируют и в кристаллических состояниях, особенно при низких температурах.
Люминесценцией обладают, и многие стекла в состав которых включены ионы люминесцентных веществ: уранила, редкоземельных элементов и др. По характеру спектров они близки к спектрам растворов соответствующих активаторов.
Дата добавления: 2015-03-03; просмотров: 1271;
