Пожарная опасность и противопожарная защита химических реакторов
Пожаровзрывоопасность химических реакторов определяют следующие факторы:
1) физико-химические и пожароопасные свойства исходных реагентов и продуктов реакции;
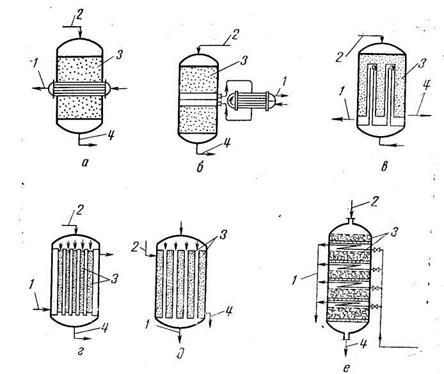
Рис. 16.2. Схемы теплообменных устройств в реакторах вытеснения: а — внутренний теплообменник;
б — наружный теплообменник; в — двойные трубки; г, д — кожухотрубчатые теплообменники;
е — внутренние змеевики; / — теплоноситель (хладагент); 2 — исходное вещество; 3 — катализатор;
4 — продукты реакции
2) свойства реакционной среды и применяемых катализаторов (инициаторов);
3) параметры процесса, происходящего в реакторе (давление, температура, объемная или массовая скорость);
4) тип и конструктивные особенности реактора.
В период нормального ведения технологического процесса горючая среда в реакторе не образуется, так как в исходных реагентах и продуктах реакции отсутствует окислитель. Горючая среда может образоваться в периоды загрузки или выгрузки, при замене отработанного катализатора, поскольку эти операции связаны с остановкой и вскрытием реактора. Безопасная работа реактора после его остановки обеспечивается предварительной тщательной продувкой от горючих паров и газов.
Применяемые в реакторах катализаторы весьма разнообразны по составу. Это металлы, соли, кислоты, щелочи, металлоорганические соединения, перекиси, гидроперекиси, диазосоединения и др. Катализаторы могут быть очень пожаровзрывоопасными. Так, металлоорганические соединения обладают большой химической активностью, самовоспламеняются на воздухе, реагируют со взрывом с водой и другими веществами.
Для увеличения поверхности контакта катализатора с веществом наносят на пористую основу-носитель, обладающую развитой поверхностью (активный уголь, силикагель, керамику и др.). Катализаторы, приготовленные на основе активного угля, весьма пожаровзрывоопасны, так как склонны к самовозгоранию. Сами процессы изготовления катализаторной массы и растворов катализаторов также пожаровзрывоопасны.
В ряде случаев приходится регенерировать (восстанавливать) катализаторы после определенного срока их эксплуатации. Регенерацию осуществляют пропускавшем через реактор водорода, водяно пара или горячего воздуха. При этом, например, кокс и смолистые отложения на поверхности катализатора выжигаются подача воздуха в реактор создает условия для образования горючей среды внутри аппарата. Поэтому такие реакторы (их называют контактными) должны продуваться от горючих газов и паров перед регенерацией катализатора и от воздуха — перед контактированием.
Горючая среда образуется в реакторах, в которых осуществляется процессы окисления органических веществ окислителями (например, хлорирование), если нарушается безопасное соотношение между горючим и окислителем при подаче их в реактор. Во избежание этого регулируют подачу реагентов, используя автоматические регуляторы расхода и соотношения компонентов. При нормальном ходе технологического процесса выход горючих газов, паров и жидкостей из реакторов исключен, так как они герметически закрыты. Выход горючих веществ в производственное помещение или на открытую площадку возможен только в случае появления каких-то повреждений либо возникновения аварий. Повреждения реакторов (аварии) наступают при нарушении Материального баланса, нарушении теплового баланса, нарушении режима давления в аппарате, а также в результате коррозии и эрозии материала реактора.
Материальный баланс реактора — это состав и количество исходных веществ, обращающихся в реакторе, и продукты реакции. Просчеты, допущенные при составлении материального баланса, влияют на пожаровзрывоопасность реактора и соединенных с ним аппаратов. Составление материального баланса реактора представляет трудности часто потому, что помимо основной реакции в реакторе могут протекать побочные; исходные продукты могут реагировать между собой по различным схемам, а также с уже готовым продуктом. Все это следует учитывать при составлении материального баланса реактора.
Материальный баланс непрерывно действующих проточных реакторов составляется, как правило, для стационарного (установившегося) режима. В этом случае общая масса веществ, поступивших в аппарат за определенный промежуток времени, равна массе веществ, вышедших из аппарата, то есть:
Gт + Gж + Gг = G’r + G’ж + G'r, (16.3)
где GT, GtK, Gr — соответственно масса твердых, жидких и газообразных веществ, поступающих в реактор; GT, Gx, Gr — масса веществ, выходящих из реактора.
Если в производственном процессе отсутствует какая-либо фаза или используются несколько веществ одной какой-либо фазы, формула (16.3) соответственно либо упрощается, либо усложняется. Обычно масса основного продукта задается (закладывается в проект или замеряется в действующем производстве).
Материальный баланс чаще всего составляют из расчета расхода сырья и получения побочных продуктов на единицу основного продукта (килограмм, тонну, кмоль). Иногда баланс относят к единице массы сырья или к единице времени (час, сутки, месяц и
т. д.).
При составлении полного баланса обычно приходится решать систему уравнений типа (16.3) с двумя или тремя неизвестными. При этом используются формулы для вычисления выхода продукта, скорости процесса и др. Иногда составляется .баланс для какой-либо одной фазы гетерогенного процесса, происходящего в реакторе. Тогда из-за перехода веществ из одной фазы в другую масса веществ, поступающих в реактор с данной фазой, не равна массе веществ, выходящих из реактора. В реакторе происходит накопление или убыль количества веществ данной фазы. Уравнение материального баланса, например для газовой фазы, в этом случае принимает вид:
Gr + Ga = G’r + Gy, (16.4)
где GH — количество вещества в реакторе, накапливающегося в газовой фазе;
Gy — количество вещества в реакторе, убывающего из газовой фазы.
В простейшем случае составляют баланс по одному из исходных веществ или по целевому продукту. Так, для исходного вещества А при установившемся режиме в проточном реакторе уравнение материального баланса будет иметь вид:
GАП=GАВ+ GАр, . (16.5)
где GАП—количество вещества А, поступившего в реактор; GАВ -
количество вещества А, вышедшего из реактора; Gp—количество вещества Л, вступившего в реакцию.
Окончательный вид уравнения материального баланса реактора зависит от его типа. Для реактора периодического действия оно простое:
Gn=Goc, (16.6)
где Gn — количество веществ, поступивших в реактор; Сос — количество веществ, остающихся (накапливающихся) в реакторе. Для реакторов непрерывного действия уравнение материального баланса при установившемся потоке вещества имеет вид:
Gn=GB+Gp. (16.7)
Для элементарного объема реакционного пространства реактора с вытеснением справедливо соотношение
Wdx=rдV, (16.8)
где W — объемный расход смеси реагентов (питание реактора);: X — степень превращения; r — скорость химической реакции; V — реакционный объем.
Степень превращения х есть отношение количества израсходованного вещества к общему его количеству в начале процесса:
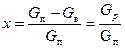 . (16.9)
. (16.9)
Для реактора непрерывного действия с перемешиванием можно принять, что состав реакционной смеси будет одинаков во всем реакционном объеме. Поэтому и скорость реакции будет величиной постоянной. Тогда уравнение материального баланса для реактора непрерывного действия с перемешиванием примет вид:
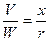 (16.10)
(16.10)
Нормальная работа реактора обеспечивается в том случае, если , его объем соответствует количеству веществ, поступающих в реактор, выходящих из него, а также накапливающихся в нем. Если это условие не выдерживается, материальный баланс реактора нарушается, что может привести к аварийным ситуациям, повреждениям аппаратов, пожарам в цехах и на открытых площадках. Так, увеличение массовой или объемной скорости подачи исходных реагентов в реактор приводит к переполнению аппарата, повышению в нем давления. Повыситься давление может и при повышении производительности питающих насосов (или компрессоров), при повышении гидравлических сопротивлений линий в результате образования отложений, загрязнений, пробок. Чтобы избежать этого, следует:
оборудовать автоматическими регуляторами расхода линии питания реакторов и отвода продуктов;
для подачи и отвода продуктов из реактора использовать более надежные центробежные насосы и турбокомпрессоры с устройствами сигнализации о работе электродвигателей; питание рабочих и резервных электродвигателей осуществлять от независимых источников;
оборудовать реакторы автоматическими регуляторами уровни системой сигнализации;
осуществлять контроль за образованием отложений в продуктовых линиях; регулярно очищать эти линии от загрязнений и. отложений; вводить в процесс ингибиторы для исключения образования полимеров.
Увеличение скорости химических реакцийможет привести к значительному повышению давления в реакторе, а также в других аппаратах, соединенных с ним. Повысится температура до опасных уровней, при которых возможно воспламенение или взрыв реакционной смеси.
Нарушение режима теплообмена(например, в результате загрязнения теплообменной поверхности или прекращения подачи хладагента) вызывает повышение температуры реакционной среды, а повышение температуры приводит к соответствующему изменению скорости реакции. Согласно правилу Вант-Гоффа, повышение температуры на 10 градусов вызывает увеличение скорости химической реакции в 2...4 раза. Для большинства реакций зависимость скорости реакции от температуры выражается уравнением Аррениуса:
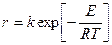 , (16.11)
, (16.11)
где r — скорость реакции; k — константа скорости реакции; Е — энергия активации; R — универсальная газовая' постоянная; Т —. температура.
На скорость химической реакции в реакторе влияет концентрация реагирующих веществ. Вступает в силу закон действия масс, согласно которому скорость химической реакции в данный момент прямо пропорциональна произведению молярных концентраций реагирующих веществ. Согласно закону действия масс, количество полученного продукта G (для простой реакции) изменяется с течением времени по восходящей логарифмической кривой (рис. 16.3). Скорость реакции r, выраженная количеством полученного продукта за единицу времени, уменьшается во времени по нисходящей кривой. Такой характер кривых отражает кинетику процессов для многих химических реакций в реакторах периодического действия и в проточных аппаратах, близких по режиму к аппаратам идеального вытеснения. В других случаях механизм взаимодействия и кинетические кривые усложняются.
Для ускорения протекания химических процессов используют катализаторы. Под их влиянием происходит снижение энергии активации реакций. Из уравнения Аррениуса (16.11) следует, что даже небольшое уменьшение энергии активации может привести к значительному увеличению скорости химической реакции. Поэтому важно обеспечение точной дозировки подаваемых в реактор катализаторов (инициаторов).
Если химический процесс протекает по цепному механизму, скорость разветвления цепей пропорциональна концентрации веществ и объему реактора. Для таких реакций существуют критические условия. Нарушение этих условий по уровню температуры и давления, по концентрации, катализатору (инициатору) и примесям может привести к лавинообразному характеру процесса и взрыву.
В качестве мер пожарной профилактики предусматривается: автоматическое регулирование температуры исходных реагентов; контроль за дозировкой катализатора (инициатора); автоматическое регулирование подачи дозировочных насосов; контроль за концентрацией реагирующих веществ; предварительная очистка исходных реагентов от примесей; соблюдение установленного коэффициента заполнения реактора.
Свободный объем в реакторе необходим при проведении процессов, связанных с перемешиванием, пено- и парообразованием.
Тепловой баланс реактора(температурный режим его работы) составляется на основе закона сохранения энергии, который применительно к реакторам можно сформулировать так: приход тепла в реактор должен быть равен расходу тепла в реакторе:
Qn±QP±QT = Qy + QnoT, (16.12)
где Qn — количество тепла, поступающее в реактор с исходными продуктами;
Qp — тепловой эффект химической реакции; QT — количество тепла, необходимое (+) или отводимое из реакционной зоны (—); Qy — количество тепла, уходящее из реактора с конечными продуктами; QnoT — потери тепла в окружающую среду. Величины Qn и Qy в технологии называют теплосодержанием материалов. Теплосодержание вычисляют отдельно для каждого вида поступающего и выходящего продукта по формуле
Q = Gct, (16.13)
где G — количество (масса) материала; с — его теплоемкость; t —температура материала.
Теплоту физических процессов (конденсации, растворения, кристаллизации) вычисляют по формуле
Qф=G1S, (16.14)
где G1— количество (масса) вещества, претерпевающего фазовые переходы; s — теплота фазовых переходов (конденсации, кристаллизации, растворения и т. п.).
Величина теплового эффекта химического процесса в значительной степени определяет выбор типа реактора. В адиабатических реакторах проводят, как правило, процессы с небольшим тепловым эффектом, а также реакции, протекающие с очень большой скоростью в присутствии высокоактивных катализаторов и при быстром охлаждении («закалке») продуктов реакции.
В реакторах периодического действия скорость реакции (рис. 16.3) уменьшается по мере уменьшения концентрации реагирующих веществ. Уменьшается, следовательно, и скорость тепловыделения. В реакторах непрерывного действия уменьшение концентрации реагирующих веществ непрерывно компенсируется подачей новых порций реагентов в реакционный объем. Наиболее благоприятным по безопасности является изотермический режим в реакторе. Однако его реализация в промышленных условиях связана со значительными сложностями из-за неравномерной скорости выделения (поглощения) тепла. В начальный период процесса (или в начальной зоне реактора) может выделяться большое количество тепла, своевременный отвод которого трудно осуществить равномерно из всей зоны реакционного объема. И чем больше отклонения от изотермического режима в сторону увеличения температуры, тем больше увеличивается скорость реакции, тем больше выделяется тепла. Процесс саморазгоняется,
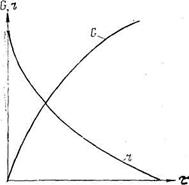
Рис. 16.3. Кинетика химического процесса в соответствии с законом действующих масс (р, t = const)
становится опасным.
Отклонения от изотермического режима могут быть вызваны следующими причинами: несоответствием теплообменных устройств количеству тепла, которое необходимо отводить из реактора; нарушением режима эксплуатации реактора (перегрузка, завышение количества катализатора); нарушением режима эксплуатации теплообменных устройств (уменьшение подачи хладагента, повышение его температуры; загрязнение теплообменных поверхностей).
Одна из наиболее распространенных причин аварий и пожаров в химических реакторах — нарушение температурного режима их работы. Поэтому химические реакторы должны иметь надежную систему автоматического регулирования температуры, которая бы обеспечивала сохранение теплового баланса.
Нарушение режима давления в реакторах влияет на скорость протекания химической реакции, способствует смещению химического равновесия и, следовательно, превращению исходных веществ в продукты реакции. В гомогенных процессах, протекающих в газовой фазе, или в гетерогенных процессах с участием газовых компонентов повышение давления уменьшает объем газовой, фазы и соответственно увеличивает концентрации взаимодействующих веществ. Таким образом, повышение давления равносильно повышению концентрации реагентов.
Скорость гомогенного процесса в газовой фазе можно выразить через давление:
r=βрn, (16.15)
где β — коэффициент, зависящий от константы скорости реакции и движущей силы процесса; р — давление; n — порядок реакции (число молекул, участвующих в каждом элементарном акте).
Для реакций первого порядка (п=1) скорость реакции прямо пропорциональна давлению. Для реакций второго и высших порядков (л>1) скорость реакции изменяется по параболическому закону (рис. 16.4). Согласно рис. 16.4, увеличивать давление в системе очень выгодно: увеличивается скорость реакции, уменьшается объем газовой смеси и, следовательно, уменьшается реакционный объем, что дает возможность использовать реакторы меньших размеров. Однако существуют оптимальные значения давления. Дело в том, что приращение выхода готового продукта с повышением давления постепенно снижается. Поэтому наступает область, когда дальнейшее увеличение давления становится невыгодным (рис. 1Ь.5, кривая /).
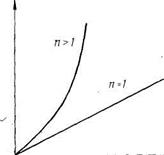
Рис. 16.4. Влияние давления на скорость реакций (п — порядок реакции)
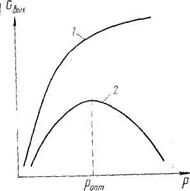
Рис. 16.5. Зависимость выхода продукта от давления для обратимых газовых реакций: 1 — реакции с уменьшением объема; 2 —реакции: с увеличением объема
В промышленности для различных процессов рациональное значение давления колеблется от 0,1 до 10... 100 МПа. Многие процессы, такие, как синтез аммиака, метанола и др. (которые проходят с уменьшением объема продуктов реакции), осуществляются при высоких давлениях, превышающих 10 МПа. Для обратимых газовых реакций, идущих с увеличением объема продуктов реакции, давление сказывается положительно вдали от состояния равновесия (за счет роста концентраций исходных компонентов). Однако в области равновесия выход продукта проходит через максимум (рис. 16.5, кривая 2) и затем снижается. Поэтому использование повышенного давления для этих реакций, как правило, связано с получением выгод от использования давления в предыдущих или последующих операциях производства.
Для процессов, протекающих в жидкой фазе (например, полимеризации), эффективно высокое давление, достигающее 100МПа и более. При этих условиях, несмотря на малую сжимаемость жидкостей, скорость многих реакций в жидкой фазе значительно увеличивается.
Главный вопрос пожаровзрывоопасности при работе реакторов под повышенным давлением — обеспечение надежной механической прочности аппаратов и герметизации их узлов. А это предполагает устройство предохранительных клапанов с отводом газов на свечу или факел; устройство взрывных клапанов, если возможен взрыв; применение специальных прокладочных материалов, соответствующих температуре, давлению и свойствам веществ, находящихся в реакторе.
Коррозия и эрозия материала конструкций реактора.Материалы, из которых делают реакторы, подвержены коррозии и эрозии. Это снижает их механическую прочность. Для защиты от коррозии предусматривается:
применение коррозионностойких материалов (свинца, стекла, эмали, высоколегированных сталей и др.);
футеровка, то есть покрытие внутренней поверхности реактора химически стойкими облицовочными материалами (кислотоупорным кирпичом, графитовыми плитками и т. п.);
использование защитных покрытий из органических материалов (резины, каучука, пластмассы) и лакокрасочных покрытий: бакелитового, эпоксидного, перхлорвинилового лаков;
контроль за состоянием поверхностей и покрытий реактора.
Реакторы подвергаются и эрозийному износу, особенно когда применяются процессы с движущимися твердыми катализаторами. В таких реакторах должны использоваться материалы, устойчивые к эрозии. Предусматривается также предварительная очистка исходного сырья от твердых примесей.
Дата добавления: 2015-02-23; просмотров: 3335;
