Электрохимическая коррозия (ЭХК).
Первопричиной ЭХК является термодинамическая неустойчивость металла в конкретных коррозионных условиях [6].
При соприкосновении 2-х электропроводящих фаз между ними возникает разность электрических потенциалов, что связано с образованием двойного электрического слоя, т.е. несимметричного распределения заряженных частиц у границы раздела фаз.
На рис. 2.54 показан пример коррзионного растрескивания трубы из нержавеющей стали, находившейся в течение нескольких месяцев под воздействием хлоридов.
Механизм возникновения скачка потенциала на границе металл-
электролит.
Находящиеся на поверхности металла катионы имеют некоторый запас потенциальной энергии. Внедрение их в металл, т.е. сближение с соседними катионами кристаллической решетки металла требует большой работы по преодолению сил отталкивания. Это может быть выражено восходящей энергетической кривой.
Отрыв катиона от поверхности металла с переходом в вакуум требует еще большей энергии, возникающей обычно при нагреве.
Полярные молекулы растворителя, например воды, соответственно ориентируясь около поверхностных катионов, облегчают переход катионов в раствор с освобождением энергии. В водном растворе это называется энергией гидратации. При переходе в раствор катион металла должен преодолеть энергетический барьер меньшей величины, чем из раствора в металл.
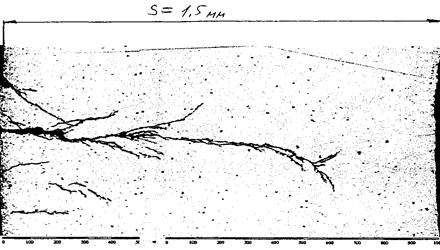
Рис. 2.54
Коррозия стенки трубы Æ16x1,5 из стали 08Х18Н10Т в среде хлоридов.
Поэтому более вероятно пересечение фазовой границы только ионов металла. Здесь происходят два сопряженных процесса:
1) переход этих ионов (катионов) из металла в раствор с образованием гидратированных ионов – окислительный или анодный процесс;
2) разряд этих ионов из раствора с выделением их на поверхность металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла- восстановительный или катодный процесс.
Преобладание одного из таких процессов определяется уровнем потенциальной энергии катионов в узлах кристаллической решетки металла U1 и в растворе U2.
При U1> U2 имеет место анодный процесс; при U1< U2 – катодный.
Скорость того и другого равна разности плотностей токов
ia = 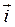 -
- 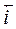 - для анодного процесса; ik =
- для анодного процесса; ik = 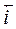 -
- 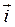 - для катодного процесса.
- для катодного процесса.
В случае анодного процесса переход части катионов (положительных ионов) металла в раствор снижает среднюю потенциальную энергию поверхностных катионов. При этом на поверхности металла появляются избыточные отрицательные заряды.
Повышение концентрации ионов у металлической поверхности приводит к приобретению раствором избыточного положительного заряда, что затрудняет протекание прямого процесса и облегчает протекание обратного процесса.
Если U1= U2, то наступает динамическое равновесие, когда 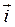 -
- 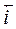 = = i0 является током обмена. При этом коррозия не происходит. В таблице приведены значения плотностей тока обмена для некоторых металлов. Табл. 2.14
= = i0 является током обмена. При этом коррозия не происходит. В таблице приведены значения плотностей тока обмена для некоторых металлов. Табл. 2.14
Стандартные токи обмена металлов в водных растворах при T= 20°C
| Металл | Растворитель | i0, А/см2 |
| Fe | FeSO4 | 10-7 |
| Co | CoSO4 | 1,3*10-5 |
| Cu | CuSO4 | 10-4 |
| Ni | NiCl2 | 10-8…10-7 |
| Zn | ZnSO4 | 4*10-4 |
Установившийся при достижении равновесия обратный (равновесный) потенциал металла (Uме)обр, являющийся разностью электрических потенциалов металла и раствора, может быть рассчитан по уравнению:
(Uме)обр= (Uме)ообр+ RT(nF)-1ln(aMeh+), (2-45)
где n - валентность ионов, пересекающих границу; F = 23062 кал/г-экв- постоянная Фарадея; R= 1,987- газовая постоянная; Т- температура Кельвина; aMe = mMeh+ g± - активность ионов металла в растворе; mMeh+ - концентрация ионов металла в растворе [г-ион/100г растворителя]; g± - средний коэффициент активности электролита; (Uме)ообр - стандартный потенциал металла по отношению к стандартному водородному электроду: обратимый потенциал металла при активности его ионов в растворе, равный единице В.
Стандартный потенциал водородного электрода условно принят равным нулю при любых температурах и в любых растворителях (он в разных растворителях разный и зависит от температуры).
Часто пользуются не величиной активности водородных потенциалов, а ее логарифмом, обозначаемым символом pH. Он называется водородным показателем
pH= -lgaH+= - lg(mH+g±). (2-46)
Так, возможно aH+=10-14, тогда pH=14.
В водных растворах носителем кислотных свойств являются ионы гидроксония H3O+, в неводных растворах - другие ионы.
ЭХК металлов трактуется как работа гальванического элемента, где отрицательный электрод, например Zn, растворяется, когда он соединен проводником со вторым электродом, на котором восстанавливаются ионы водорода или другого вещества.
Поверхность корродирующего металла обычно представляет собой многоэлектродный гальванический элемент (рис.2.55).

Рис. 2.55
Схема 5-ти электродного коррозионного
гальванического элемента.
Катодом считается элемент с более положительным электродным потенциалом. Такими элементами могут быть:а) включения; б) участки сплава, обогащенные компонентами с более положительным электродным потенциалом; в) участки металла, соприкасающиеся с раствором с более низким рН или большей концентрацией кислоты или другого окислителя.
Анодом (более отрицательный электродный потенциал) являются: а) металл в порах; б) более деформированные и напряженные участки металла; в) атомы или группы атомов металла с более отрицательным электродным потенциалом; участки металла, соприкасающиеся с более концентрированными растворами солей; г) участки металла, где положительные заряды (катионы) выходят в электролит.
При замыкании в электролите 2-х обратимых электродов с разными потенциалами происходит перетекание электронов от более отрицательного (анода) к менее отрицательному (катоду) или более положительному электроду. Это перетекание выравнивает значения потенциалов, но анодный (выход ионов металла в электролит) и катодный (ассимиляция электронов) процессы продолжаются и деполяризуют коррозионный процесс. Однако из-за отставания электродных процессов от перетока электронов потенциалы электродов сближаются, т.е. деполяризация задерживается.
Скорость ЭХК или коррозионный ток определяется соотношением
iкорр= (Uk)обр- (Ua)обр]/(R+P), (2-47)
где R- омическое сопротивление корродирующей системы; Р- поляризационное сопротивление системы.
В таблице приведены некоторые стандартные обратимые электродные потенциалы элементов в разных растворителях.
Табл. 2.15
Стандартные обратимые электродные потенциалы металлов
| Электрод | U°обр, [B] в растворителях | |||
| H2O | CH3OH | CH3CN | NH3 | |
 H+/1/2H2 H+/1/2H2
| ||||
| Li+/L | -3,01 | -3,095 | -3,23 | -2,24 |
| Ca+/Ca | -2,97 | -2,915 | -2,75 | -1,64 |
| Zn2+/Zn | -0,761 | -0,74 | -0,74 | -0,53 |
| Cu2+/Cu | +0,397 | +0,34 | -0,26 | +0,43 |
Собственно коррозия (растворение) реализуется в анодном процессе ионизации металла.
Внешние факторы ЭХК металлов
Это температура, давление, скорость движения среды, внешняя поляризация.
 Для характеристики водородных ионов в растворе принят водородный показатель рН. Он являет на скорость ЭХК металлов, изменяя потенциал катодных деполяризационных реакций (рис. 2.56) .
Для характеристики водородных ионов в растворе принят водородный показатель рН. Он являет на скорость ЭХК металлов, изменяя потенциал катодных деполяризационных реакций (рис. 2.56) .
Рис. 2.56
Основные типы зависимостей скорости коррозии (К) от рН.
Все металлы по зависимости скорости ЭХК от рН раствора можно разбить на 5 групп:
1) металлы, достаточно устойчивые в кислых и щелочных растворах (кривая 1)- Au, Pt, Ag;
2) металлы малостойкие в кислых, нейтральных и коррозионностойкие в щелочных растворах (кривая 2)- Mg, Fe;
3) металлы, неустойчивые в кислых, но коррозионностойкие в щелочных растворах (кривая 3)- Ni, Co, Cd;
4) металлы коррозионностойкие в кислых, но неустойчивые в щелочных растворах (кривая 4)- Ta,Mo, W;
5) металлы коррозионностойкие в нейтральных, но неустойчивые в кислых и щелочных растворах (кривая 5).
Дистиллированная вода имеет рН» 7.
Для группы 3 скорость коррозии по данным Шаталова А.Я. описывается уравнением
K-m= const anH+ , ( 2-47)
Так, для Fe – n=0,42; Mg- n=2; Zn- n=1,1.
Скорость ЭХК металлов в растворах зависит от природы растворенной соли и ее концентрации.
Некоторые виды ЭХК
Щелевая коррозия- усиленное коррозионное разрушение металла конструкций в щелях и зазорах. Она наблюдается не только при погружении металла в электролит, но и в атмосферных условиях. Существенно ухудшает работу металлических конструкций. Наибольшей чувствительностью к щелевой коррозии обладают пассивирующиеся металлы (хромистые и хромоникелевые стали, алюминиевые сплавы). Это связано с их возможной активацией в щелях.
Для процесса щелевой коррозии характерна пониженная концентрация окислителей (кислород и др.) по сравнению с концентрацией вне щели в объеме раствора и затрудненность отвода продуктов коррозии, из-за накопления и гидролиза которых возможно изменение рН раствора в щели и кинетики анодного и катодного процессов в щели.
Затрудненность доставки в щель окислителя (часто возможна только диффузией) затрудняет катодный процесс, увеличивая деполяризуемость. Снижение pH за счет гидролиза облегчает протекание анодного процесса (облегчает ионизацию металла и затрудняет образование защитных пленок). Это приводит к усиленной работе микропары: металл в щели (анод)- металл открытой поверхности (катод).
Снижение поляризуемости анодного процесса может быть настолько сильным, что будет происходить процесс коррозии с водородной деполяризацией, дополнительно увеличивающий коррозионный ток. Исследования показывают, что края щели работают как анод, а середина - как катод.
Для защиты от щелевой коррозии применяют следующие методы:
1. Уплотнение зазоров и щелей, в том числе, полимерными пленками, резиной, смазкой.
2. Рациональное конструирование, исключающее попадание агрессивной среды в зазоры.
3. Выбор материалов, малосклонных к щелевой коррозии- сталей, содержащих молибден Х18Н12М3Т, высокохромистых сталей Х27, титана и его сплавов.
4. Применение ингибиторов.
5. Электрохимическая защита- катодная (для углеродистых сталей, чугуна), анодная (для хромистых сталей и титана).
Точечная (питтинговая) коррозия
Наблюдается у металлов и сплавов в пассивном состоянии, когда коррозии со значительной скоростью подвержены отдельные небольшие участки поверхности. Это приводит к образованию глубоких поражений. Такой процесс бывает у хромистых и хромоникелевых сталей, алюминия и его сплавов, никеля, титана в растворах NaCl, морской воде, растворах хлорного железа, в смесях азотной и соляной кислот и др.
Различают 3 стадии развития питтинга:
а) в слабых местах пассивной пленки, обусловленных неоднородностью структуры металла, случайными механическими повреждениями защитной пленки и др.;
б) из-за интенсивности растворения защитной пленки;
в) иногда при значительном числе питтингов в начальный период коррозии (в процессе коррозии число питтингов остается примерно постоянным).
Для защиты металлических конструкций с кислородной деполяризацией в нейтральных электролитах (пресной и морской воде, водных растворах солей, грунтах) существуют следующие методы:
1. Применение достаточно устойчивых металлов и сплавов.
2. Удаление из электролита деполяризатора- кислорода, деаэрация или обезкислороживание воды котлов, охлаждающих систем.
3. Введение в воду растворов добавок, замедляющих коррозию.
Дата добавления: 2015-02-19; просмотров: 1905;
