Лекция 1.
Введение. Предмет теплотехники. Основные понятия и определения. Термодинамическая система. Параметры состояния. Температура. Давление. Удельный объем. Уравнение состояния. Уравнение Ван-дер-Ваальса.
Введение.Теплотехника – наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепловых машин, аппаратов и устройств. Теплота используется во всех областях деятельности человека. Для установления наиболее рациональных способов ее использования, анализа экономичности рабочих процессов тепловых установок и создания новых, наиболее совершенных типов тепловых агрегатов необходима разработка теоретических основ теплотехники. Различают два принципиально различных направления использования теплоты – энергетическое и технологическое. При энергетическом использовании, теплота преобразуется в механическую работу, с помощью которой в генераторах создается электрическая энергия, удобная для передачи на расстояние. Теплоту при этом получают сжиганием топлива в котельных установках или непосредственно в двигателях внутреннего сгорания. При технологическом - теплота используется для направленного изменения свойств различных тел (расплавления, затвердевания, изменения структуры, механических, физических, химических свойств). Такими теоретическими разделами являются техническая термодинамика и основы теории теплообмена, в которых исследуются законы превращения и свойства тепловой энергии и процессы распространения теплоты. Данный курс является общетехнической дисциплиной при подготовке специалистов технической специальности.
Предмет и метод термодинамики.Термодинамика изучает законы превращения энергии в различных процессах, происходящих в макроскопических системах и сопровождающихся тепловыми эффектами. Макроскопической системой называется любой материальный объект, состоящий из большого числа частиц. Размеры макроскопических систем несоизмеримо больше размеров молекул и атомов.
В зависимости от задач исследования рассматривают техническую или химическую термодинамику, термодинамику биологических систем и т. д. Техническая термодинамика изучает закономерности взаимного превращения тепловой и механической энергии и свойства тел, участвующих в этих превращениях. Вместе с теорией теплообмена она является теоретическим фундаментом теплотехники. На ее основе осуществляют расчет и проектирование всех тепловых двигателей, а также всевозможного технологического оборудования.
Рассматривая только макроскопические системы, термодинамика изучает закономерности тепловой формы движения материи, обусловленные наличием огромного числа непрерывно движущихся и взаимодействующих между собой микроструктурных частиц (молекул, атомов, ионов).
Физические свойства макроскопических систем изучаются статистическими термодинамическими методами. Статистический метод основан на использовании теории вероятностей и определенных моделей строения этих систем и представляет собой содержание статистической физики. Термодинамический метод не требует привлечения модельных представлений о структуре вещества и является феноменологическим (т. е. рассматривает «феномены» — явления в целом).
При этом все основные выводы термодинамики можно получить методом дедукции, используя только два основных эмпирических закона термодинамики.
В дальнейшем, исходя из термодинамического метода мы будем для наглядности использовать молекулярно-кинетические представления о структуре вещества.
Основные понятия и определения.Термодинамика в широком смысле - это наука об энергии и ее свойствах. Название происходит от греческих слов "термос" - тепло и "динамис" - сила.
Она охватывает область физических химических и других явлений, сопровождающихся тепловым эффектом в процессе превращения форм движения материй. Термодинамика основывается на двух экспериментально установленных законах, получивших название первого и второго начал термодинамики.
В зависимости от круга рассматриваемых вопросов различают физическую, химическую и техническую термодинамику.
Технической термодинамикой называется наука, изучающая вопросы взаимного превращения теплоты и работы. Ее основная задача заключается в обосновании теории тепловых двигателей.Определение: Термодинамика - наука о закономерностях превращения энергии.
В термодинамике широко используется понятие термодинамической системы.
Определение: термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой. Все тела находящиеся за пределами границ рассматриваемой системы называются окружающей средой.
Поскольку одно и то же тело, одно и то же вещество при разных условиях может находиться в разных состояниях, (пример: лед-вода-пар, одно вещество при разной температуре) вводятся, для удобства, характеристики состояния вещества – так называемые параметры состояния.
Перечислим основные параметры состояния вещества:
Температура тел - определяет направление возможного самопроизвольного перехода тепла между телами.
В настоящее время в мире существует несколько температурных шкал и единиц измерения температуры. Наиболее распространенная в Европе шкала Цельсия где нулевая температура - температура замерзания воды при атмосферном давлении, а температура кипения воды при атмосферном давлении принята за 100 градусов Цельсия (ºС). В Северной Америке используется шкала Фаренгейта. Для термодинамических расчетов очень удобна абсолютная шкала или шкала Кельвина. За ноль в этой шкале принята температура абсолютного нуля, при этой температуре прекращается всякое тепловое движение в веществе. Численно один градус шкалы Кельвина равен одному градусу шкалы Цельсия.
Температура, выраженная по абсолютной шкале, называется абсолютной температурой.
Соотношение для перехода от градусов Цельсия к градусам Кельвина:
T [K] = t [º C] + 273.15
T-температура в Кельвинах;
t - температура в градусах Цельсия.
Давление - представляет собой силу, действующею по нормали к поверхности тела и отнесенную к единице площади этой поверхности.
Для измерения давления применяются различные единицы измерения. В стандартной системе измерения СИ единицей служит Паскаль (Па).
Соотношение между единицами:
1 бар = 105 Па
1 кг/см2 (атмосфера) = 9.8067 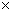 104 Па
104 Па
1мм рт. ст (миллиметр ртутного столба) = 133 Па
1 мм вод. ст. (миллиметр водного столба) = 9.8067 Па
Плотность - отношение массы вещества к объему занимаемому эти веществом.
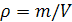
Удельный объем - величина обратная плотности, т.е. отношения объема занятого веществом к его массе.
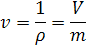
Определение: Если в термодинамической системе меняется хотя бы один из параметров любого входящего в систему тела, то в системе происходит термодинамический процесс.
Основные термодинамические параметры состояния Р, V, Т однородного тела зависят один от другого и взаимно связаны уравнением состояния:
F (P, V, Т)
Для идеального газа уравнение состояния записывается в виде:
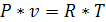
где:
P - давление
v - удельный объем
T - температура
R - газовая постоянная (у каждого газа свое значение)
Если известно уравнение состояния, то для определения состояния простейших систем достаточно знать две независимые переменные из 3-х
Р = f1 (v, т); v = f2 (Р, Т); Т = f3 (v, Р).
Термодинамические процессы часто изображаются на графиках состояния, где по осям отложены параметры состояния. Точки, на плоскости такого графика, соответствуют определенному состоянию системы, линии на графике соответствуют термодинамическим процессам, переводящим систему из одного состояния в другое.
Рассмотрим термодинамическую систему, состоящую из одного тела какого-либо газа в сосуде с поршнем, причем сосуд и поршень в данном случае является внешней средой. Пусть, для примера, происходит нагрев газа в сосуде, возможны два случая:
1) Если поршень зафиксирован, и объем не меняется, то произойдет повышение давления в сосуде. Такой процесс называется изохорным (v=const), идущий при постоянном объеме;
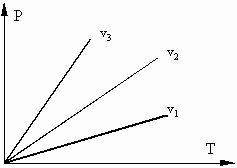
Рис. 1.1. Изохорные процессы в P - T координатах: v1>v2>v3
2) Если поршень свободен, то нагреваемый газ будет расширяться, при постоянном давлении такой процесс называется изобарическим (P=const), идущим при постоянном давлении.
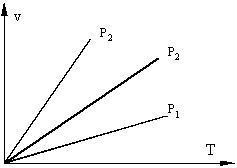
Рис. 1.2 Изобарные процессы в v- T координатах: P1>P2>P3
Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако можно охлаждая сосуд при сжатии газа и нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим (Т=const).
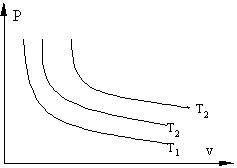
Рис. 1.3 Изотермические процессы в P-v координатах: Т1>T2 >T3
Процесс, при котором отсутствует теплообмен между системой и окружающей средой, называется адиабатным, при этом количество теплоты в системе остается постоянными (Q=const). В реальной жизни адиабатных процессов не существует поскольку полностью изолировать систему от окружающей среды не возможно. Однако, часто происходят процессы, при которых теплообменном с окружающей средой очень мал, например, быстрое сжатие газа в сосуде поршнем, когда тепло не успевает отводиться за счет нагрева поршня и сосуда.
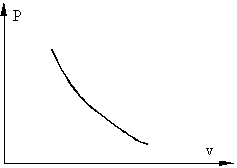
Рис. 1.4 Примерный график адиабатного процесса в P - v координатах.
Определение: Круговой процесс (Цикл) - это совокупность процессов, возвращающих систему в первоначальное состояние. Число отдельных процессов может быть любым в цикле.
Понятие кругового процесса является для нас ключевым в термодинамике, поскольку работа АЭС основана на пароводяном цикле, другими словами мы можем рассматривать испарение воды а активной зоне (АЗ), вращение паром ротора турбины, конденсацию пара и поступление воды в АЗ как некий замкнутый термодинамический процесс или цикл.
Определение: Рабочие тело - определенное количество вещества, которое, участвуя в термодинамическом цикле, совершает полезную работу.Рабочим телом в реакторной установке РБМК является вода, которая после испарения в активной зоне в виде пара совершает работу в турбине, вращая ротор.
Определение: Передача энергии в термодинамическом процессе от одного тела к другому, связанная с изменением объема рабочего тела, с перемещением его во внешнем пространстве или с изменением его положения называется работой процесса.
Дата добавления: 2015-02-16; просмотров: 2457;
