Уравнение состояния реального газа
Все полученные выше уравнения состояния справедливы только для идеальных газов. Состояния реальных газов могут описываться этими уравнениями только приближенно, поскольку здесь не учитываются силы взаимодействия между молекулами и объемы самих молекул.
За прошедшее столетие различными авторами было предложено значительное число уравнений состояния реального газа. Наибольшее применение в настоящее время имеет уравнение, полученное в 1873 г. голландским физиком Ван-дер-Ваальсом:
(p + 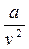 )(v - b) = RT, (2.12)
)(v - b) = RT, (2.12)
где 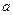 и b – постоянные для конкретного газа величины.
и b – постоянные для конкретного газа величины.
Физический смысл поправки b состоит в следующем. У реального газа молекулы занимают определенный объем, и между ними существуют силы взаимодействия. При нормальных состояниях эти силы проявляются как силы притяжения, возрастающие с уменьшением расстояния между молекулам. Но такая закономерность замечается до определенного сближения молекул. При дальнейшем уменьшении расстояния между ними возникают силы отталкивания, величина которых тем больше, чем ближе молекулы друг к другу. Силы отталкивания при некотором расстоянии между молекулами становятся такими огромными, что никакие давления далее не способны уменьшить объем газа. Величина b и есть наименьший объем, до которого представляется возможным сжать газ.
Поправка на давление вытекает из следующих соображений. У реальных газов между молекулами существуют силы притяжения. По этой причине давление реального газа имеет меньшее значение, чем давление идеального газа при одинаковых p и T ,на величину ∆р:
P= 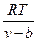 – ∆p.
– ∆p.
Величина ∆р пропорциональна квадрату числа молекул в единице объема. Поскольку молекулы реального газа обладают массой, то ∆р пропорционально квадрату плотности или обратно пропорционально квадрату удельного объема. Коэффициентом пропорциональности является величина a, тогда ∆p = a/v2. Величины a и b называются и н д и в и д у а л ьн ы м и
п о с т о я н н ы м и и зависят только от природы газа. Они могут быть определены как теоретически, так и опытным путем. Их численное значение, например, для азота следующее:
a = 0,135 (Н· м4)/кг2 и b = 0,386 10-4 м3/кг.
2.1.2. Газовые смеси
В большинстве случаев в качестве рабочих тел термодинамических систем используются не однородные газы, а их смеси, например, воздух, природный газ, продукты сгорания топлива и т.д.
Газовыми смесями называют механические смеси отдельных газов при условии отсутствия в них химических реакций.
Длительное изучение газовых смесей позволило установить их некоторые особенности:
– каждый газ, входящий в смесь, занимает весь ее объем и имеет ее температуру;
– каждый газ, находящийся в смеси, подчиняется своему уравнению состояния;
– каждый газ, занимающий объем смеси и имеющий температуру смеси, производит соответствующее индивидуальное давление на оболочку сосуда. Это давление называется п а р ц и а л ь н ы м.
Чтобы определить параметры газовой смеси, необходимо знать количество каждого газа, составляющего смесь, т.е. знать состав смеси. Состав смеси может быть задан парциальным давлениями, массовыми или объемными долями.
Дата добавления: 2015-02-16; просмотров: 1200;
