Гидролиз солей
Под гидролизом соли понимают взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Так как при этом ионы соли взаимодействуют с ионами Н+ или ОН- воды, гидролиз солей сопровождается изменением рН раствора.
Гидролиз солей многоосновных кислот или многокислотных оснований идет по ступеням. В зависимости от типа соли различают гидролиз по аниону, катиону, по катиону и аниону.
Количественно гидролиз характеризуется степенью гидролиза h и константой гидролиза:
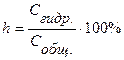 , (17)
, (17)
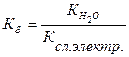 (18)
(18)
Между степенью гидролиза и константой гидролиза существует взаимосвязь:
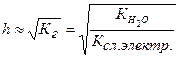 (19)
(19)
Гидролизу по аниону подвергаются соли, образованные слабой кислотой и сильным основанием.
Например, сульфид натрия Na2S (NaOH – сильное основание, Н2S – слабая кислота).
I.S2- + H2O ↔ HS- + OH- pH > 7
2Na+ + S2- + H2O ↔ 2Na+ + HS- + OH-
Na2S + H2O ↔ NaHS + NaOH
II. HS- + Н2О ↔ Н2S + OH- pH > 7
Na+ + HS- + H2O ↔ Na+ + Н2S + OH-
NaHS + H2O ↔ Н2S + NaOH
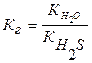
Гидролизу по катиону подвергаются соли, образованные сильной кислотой и слабым основанием.
Например, хлорид меди СuCI2 (Cu(OH)2 – слабое основание, HCI – сильная кислота).
I. Сu2+ + H2O ↔ CuOH+ + H+ pH < 7
Сu2+ + 2CI- + H2O ↔ CuOH+ + 2CI- + H+
СuCI2 + H2O ↔ CuOHCI + HCI
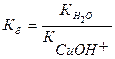
II. CuOH+ + H2O ↔ Cu(OH)2 + H+ pH < 7
CuOH+ + CI- + H2O ↔ Cu(OH)2 + CI- + H+
CuOHCI + H2O ↔ Cu(OH)2 + HCI
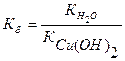
Гидролизу по катиону и аниону подвергаются соли, образованные слабым основанием и слабой кислотой.
Например, цианид аммония NH4CN (NH4OH – слабое основание, HCN – слабая кислота)
NH4+ + CN- + H2O ↔ NH4OH + HCN pH > 7, т.к. Кк-ты< Косн.
NH4CN + H2O ↔ NH4OH + HCN
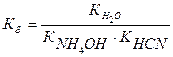
В аналитической практике гидролиз часто мешает выполнению аналитических реакций, поэтому его приходится подавлять. Так, введение в раствор продуктов гидролиза подавляет гидролиз, связывание же одного из продуктов гидролиза в результате какой-либо реакции, наоборот, усилит гидролиз.
Гидролиз также используют в аналитической практике для обнаружения или отделения ионов.
▲ Обучающие задачи
Задача №1
Определить рН раствора, концентрация ионов водорода в котором равна 0,0000386 моль/л.
 Дано: Решение:
Дано: Решение:
[H+] = 0,0000386 моль/лВыразим концентрацию ионов водорода в виде
 рН - ? произведения целого числа единиц на десять в
рН - ? произведения целого числа единиц на десять в
степени, состоящей из такого числа отрицательных единиц, сколько нулей предшествует первой значащей цифре, включая нуль целых, т.е в нашем примере [H+] = 3,86·10-5 моль/л.
Зная, что логарифм произведения равен сумме логарифмов запишем:
рН = - lg [H+] = - (lg 3,86∙10-5) = - (lg 3,86 + lg 10-5) = = - (0,5866 + (-5)) = - (- 4,4134) = 4,41
Значение lg 3,86 определяем по таблице логарифмов (см. Приложение IX, Х).
Ответ: рН = 4,41.
Задача №2
Определить концентрацию ионов [H+], если рН = 6,32.
 Дано: Решение:
Дано: Решение:
рН = 6,32 [H+] = 10 – рН
 [H+] = 10 – 6,32 = 10 – 7 · 10 0,68 = 4,786·10 – 7моль/л
[H+] = 10 – 6,32 = 10 – 7 · 10 0,68 = 4,786·10 – 7моль/л
[H+] - ? Значение 10 0,68 находим по таблице антилогарифмов (см. Приложение X, ХI).
Ответ:[H+] = 4,786·10 – 7моль/л.
Задача №3
Вычислить ионную силу 0,05М раствора Na2SO4.
 Дано: Решение:
Дано: Решение:
 С(Na2SO4) = 0,05М μ =
С(Na2SO4) = 0,05М μ = 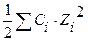
µ - ? Na2SO4 ↔ 2Na+ + SO42-
μ = 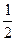 (2[Na+] ∙ 12 + [SO42-] · 22) =
(2[Na+] ∙ 12 + [SO42-] · 22) =
= 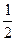 (2 ∙ 0,05 · 12 + 0,05 · 22) =
(2 ∙ 0,05 · 12 + 0,05 · 22) = 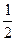 (0,1 + 0,2) = 0,15
(0,1 + 0,2) = 0,15
Ответ:μ = 0,15.
Задача №4
Чему равна ионная сила раствора, содержащего в 1л 0,01 моль КСI и 0,1 моль Ва(NO3)2?
 Дано: Решение:
Дано: Решение:
С(КСI) = 0,01 моль/л μ = 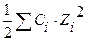
 С(Ва(NO3)2) = 0,1 моль/л КСI ↔ K+ + CI- Ва(NO3)2↔ Ba2+ + 2NO3-
С(Ва(NO3)2) = 0,1 моль/л КСI ↔ K+ + CI- Ва(NO3)2↔ Ba2+ + 2NO3-
µ - ? μ = 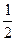 ([K+] ∙12+[CI-] ·12 +[Ba2+] ∙22+2[NO3-] · 12) =
([K+] ∙12+[CI-] ·12 +[Ba2+] ∙22+2[NO3-] · 12) =
= 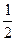 (0,01 ∙ 12 + 0,01 ∙ 12 + 0,1 ∙ 22 + 2 ∙ 0,1 ∙ 12) =
(0,01 ∙ 12 + 0,01 ∙ 12 + 0,1 ∙ 22 + 2 ∙ 0,1 ∙ 12) =
= 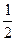 (0,01 + 0,01 + 0,4 + 0,2) = 0,31
(0,01 + 0,01 + 0,4 + 0,2) = 0,31
Ответ: μ = 0,31.
Задача №5
Вычислить концентрацию ионов Н+ в 0,1М растворе Н2S (без учета второй ступени диссоциации кислоты).
 Дано: Решение:
Дано: Решение:
С(Н2S) = 0,1М Н2S ↔ H+ + HS- (слабая кислота)
 [H+] =
[H+] = 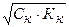
[H+] - ? Кк = 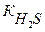 = 8,9∙10-5 моль/л (См. Приложение I)
= 8,9∙10-5 моль/л (См. Приложение I)
[H+] = 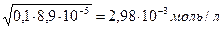
Ответ:[H+] = 2,98∙10-3 моль/л.
Задача №6
Вычислить концентрацию ионов Н+ и степень диссоциации уксусной кислоты, если известно, что в 1л её раствора содержится 2,5608г уксусной кислоты.( 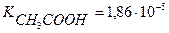 ).
).
 Дано: Решение:
Дано: Решение:
m (CH3COOH) = 2,5608г СН3СООН – слабая кислота
V = 1л = 1000мл [H+] = 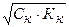 , где Ск – молярная
, где Ск – молярная
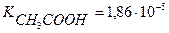 концентрация
концентрация

 См
См 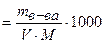
[H+] - ? См 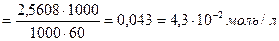
α - ? [H+] = 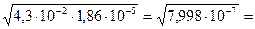
= 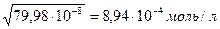
М(СН3СООН) = 60г/моль 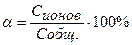
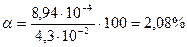
Ответ:[H+] = 8,94∙10-4 моль/л, α = 2,08%.
Задача №7
Вычислить концентрацию ионов Н+ в 0,05М растворе соляной кислоты.
 Дано: Решение:
Дано: Решение:
 С(НСI) = 0,05М НСI ↔ Н+ + СI- (сильная кислота)
С(НСI) = 0,05М НСI ↔ Н+ + СI- (сильная кислота)
[H+] - ? [H+] = Cк = 0,05 = 5 · 10-2 моль/л
Ответ:[H+] = 5 ∙ 10-2 моль/л.
Задача №8
Вычислить рН 0,01М раствора Н2SO4.
 Дано: Решение:
Дано: Решение:
 С(Н2SO4) = 0,01М Н2SO4 ↔ 2Н+ + SO42- (сильная двухосновная кислота)
С(Н2SO4) = 0,01М Н2SO4 ↔ 2Н+ + SO42- (сильная двухосновная кислота)
рН - ? [H+] = 2∙Ск=2 ∙0,01=2∙10-2
рН = - lg [H+] = - lg 2∙10-2 = - (lg 2 + lg 10-2) =
= - (0,3010 – 2) = 1,699 ≈ 1,7
Ответ:рН = 1,7.
Задача №9
Вычислить рН 0,1М раствора КОН.
 Дано: Решение:
Дано: Решение:
 С(КОН) = 0,1М КОН ↔ К+ + ОН- (сильное основание)
С(КОН) = 0,1М КОН ↔ К+ + ОН- (сильное основание)
рН - ? [OH-] = Cщ = 0,1 = 10-1 моль/л
рОН = - lg [OH-] = - lg 10-1 = 1
pH = 14 – pOH = 14 – 1 = 13
Можно при решении этой задачи пойти другим путем:
рН = - lg [H+]
[H+] = 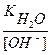 ; [OH-] = Cщ = 0,1 = 10-1 моль/л
; [OH-] = Cщ = 0,1 = 10-1 моль/л
[H+] = 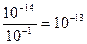
рН = - lg [H+] = - lg 10-13 = 13
Ответ:рН = 13.
Задача №10
Вычислить концентрацию гидроксид-ионов и рОН в 0,01М растворе гидроксида аммония.
 Дано: Решение:
Дано: Решение:
 С(NH4OH) = 0,01М NH4OH ↔ NH4+ + OH- (слабое основание)
С(NH4OH) = 0,01М NH4OH ↔ NH4+ + OH- (слабое основание)
[OH-] - ? [OH-] = 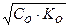
рОН - ? Ко = 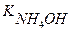 = 1,79 ∙ 10-5 (См. Приложение I)
= 1,79 ∙ 10-5 (См. Приложение I)
[OH-] = 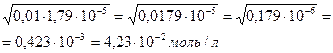
рОН = -lg [OH-] = -lg 4,23 ·10-2 = -(lg 4,23 + lg 10-2) = = - (0,6263 – 2) = 1,37
Ответ:[OH-] = 4,23∙10-2 моль/л, рОН = 1,37.
Задача №11
Вычислить рН раствора, содержащего 0,01М СН3СООН и 0,05М СН3СООNa.
 Дано: Решение:
Дано: Решение:
С(СН3СООН)=0,01моль/л Данный раствор представляет собой
 С(СН3СООNa) = 0,05моль/л буферную смесь, т.к. содержит слабую
С(СН3СООNa) = 0,05моль/л буферную смесь, т.к. содержит слабую
кислоту и её соль.
рН - ? [H+] = 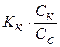
рН = - lg [H+]
Kк = 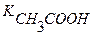 = 1,86∙10-5 (См. Приложение I)
= 1,86∙10-5 (См. Приложение I)
[H+] = 1,86∙10-5 ∙ 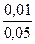 = 3,72∙10-6 моль/л
= 3,72∙10-6 моль/л
рН = - lg [H+] = - lg 3,72∙10-6 = - (lg 3,72 +
+ lg 10-6) = - (0,5705 – 6) = 5,43
Ответ:рН = 5,43.
Задача №12
Вычислить рН раствора, содержащего в 1л 0,056 моль NH4OH и 0,1 моль NH4CI.
 Дано: Решение:
Дано: Решение:
С(NH4OH)=0,056 моль/л Данный раствор представляет собой
С(NH4CI)=0,1 моль/л буферную смесь, содержащую слабое
 основание и его соль.
основание и его соль.
рН - ? [OH-] = 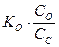
рОН = - lg [OH-], pH = 14 – pOH
Ko = 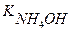 = 1,79∙10-5 (См. Приложение I)
= 1,79∙10-5 (См. Приложение I)
[OH-] = 1,79∙10-5 ∙ 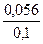 = 1,0024∙10-5 ≈ 10-5 моль/л рОН = - lg [OH-] = - lg 10-5 = 5
= 1,0024∙10-5 ≈ 10-5 моль/л рОН = - lg [OH-] = - lg 10-5 = 5
рН = 14 – рОН = 14 – 5 = 9
Ответ:рН = 9.
Задача №13
Вычислить константу гидролиза сульфита натрия по I ступени.
Решение:
Na2SO3 – соль образована сильным основанием и слабой кислотой, следовательно, гидролизуется по аниону.
Кг = 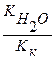
I. SO32- + H2O ↔ HSO3- + OH-
Кг = 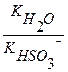 ,
,
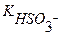 = 6∙10-8 (См. Приложение I)
= 6∙10-8 (См. Приложение I)
Кг = 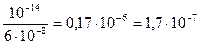
Ответ:Кг = 1,7∙10-7.
Задача №14
Вычислить константу гидролиза нитрита аммония.
Решение:
NH4NO2 – соль образована слабым основанием и слабой кислотой, следовательно, гидролизуется по катиону и аниону.
Кг = 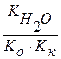
NH4+ + NO2- + H2O ↔ NH4OH + HNO2
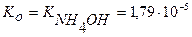
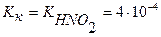 (См. Приложение I)
(См. Приложение I)
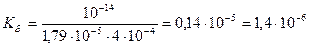
Ответ:Кг = 1,4∙10-6.
▼ Задачи для самостоятельного решения
1. Вычислить ионную силу:
а) 0,03М раствора ВаСI2; б) 0,01М раствора НСI; в) 0,02М раствора К2SO4.
Ответ: а) 0,09; б) 0,01; в) 0,06.
2. Чему равна ионная сила раствора, содержащего в 1л:
а) 0,1 моль НСI и 0,2 моль СаСI2; б) 0,02 моль NaCI и 0,1 моль Ca(NO3)2.
Ответ: а) 0,7; б) 0,32.
3. Вычислить концентрацию ионов Н+ в 0,01М растворе угольной кислоты (без учета второй ступени диссоциации кислоты).
Ответ: 6,57∙10-5 моль/л.
4. Вычислить концентрацию ионов Н+ в 0,025М растворе Н2S (без учета второй ступени диссоциации).
Ответ: 4,7∙10-5 моль/л.
5. Вычислить концентрацию ионов Н+ и степень диссоциации уксусной кислоты, если известно, что в 300 мл её раствора содержится 0,8508г СН3СООН. 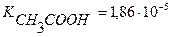 .
.
Ответ: [H+] = 9,35 10-4 моль/л; α = 1,99%.
6. Вычислить концентрацию гидроксид-ионов в растворах:
а) 0,05М NaOH; б) 0,025М NH4OH.
Ответ: а) 5∙10-2 моль/л; б) 6,69∙10-4 моль/л.
7. Вычислить концентрацию ионов Н+ в растворах:
а) 0,05М Н2SO4; б) 0,03М Ba(OH)2.
Ответ: а) 10-1 моль/л; б) 1,77 10-13 моль/л.
8. Вычислить рН:
а) 0,005М раствора НСI; б) 0,015М раствора КОН; в) 0,01М раствора СН3СООН; г) 0,001М раствора NH4OH.
Ответ: а) 2,3; б) 12,18; в) 3,37; г) 10,13.
9. Вычислить рН раствора, содержащего в 1л:
а) 0,06 моль уксусной кислоты и 0,02 моль ацетата натрия;
б) 0,045 моль гидроксида аммония и 0,15 моль хлорида аммония;
в) 0,01 моль бензойной кислоты и 0,02 моль бензоата натрия;
г) 0,025 моль муравьиной кислоты и 0,015моль формиата натрия.
Ответ: а) 4,25; б) 8,73; в) 4,49; г) 3,53.
10. Вычислить рН буферных смесей, содержащих:
а) 0,01М СН3СООН и 0,01М СН3СООNa;
б) 0,5М СН3СООН и 0,01М СН3СООNa;
в) 0,1М НСООН и 0,05М НСООNa;
г) 0,01М NH4OH и 0,05М NH4CI;
д) 0,05М NH4OH и 0,025М NH4CI.
Ответ: а) 4,73; б) 3,03; в) 3,45; г) 8,55; д) 9,55
11. Вычислить константу гидролиза следующих солей:
а) хлорида аммония; б) ацетата аммония; в) ацетата калия; г) карбоната калия по I ступени; д) нитрита натрия.
Ответ: а) 5,6∙10-10; б) 3∙10-5; в) 5,4∙10-10; г) 1,8∙10-4; д) 2,5∙10-11.
? Контрольные вопросы
1. Буферные растворы. Буферное действие растворов. Механизм действия ацетатного и аммонийного буферных растворов.
2. Приведите примеры слабых кислот (не менее 2-х) и слабых оснований (не менее 2-х). Напишите для них уравнения диссоциации, выражения констант диссоциации. Приведите формулу зависимости между константой диссоциации и степенью диссоциации.
3. Гидролиз. Определите тип гидролиза следующих солей ZnSO4, Na2CO3, NH4CN. Напишите уравнения гидролиза данных солей в ионном и молекулярном виде.
4. Значение гидролиза в аналитической практике. Как сказывается на гидролизе сульфида аммония добавление к раствору гидроксида аммония (напишите уравнение гидролиза и объясните).
Дата добавления: 2015-02-13; просмотров: 9304;
