Электролитическая диссоциация. Слабые и сильные электролиты
Реакции в водных растворах, чаще всего применяемые в анализе, представляют собой реакции ионов. Поэтому важно знать, в какой мере различные электролиты распадаются на ионы, т.е. диссоциируют.
Отношение числа молей, распавшихся на ионы, к общему числу молей растворенного электролита называется степенью электролитической диссоциации(α):
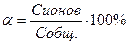 (1)
(1)
Степень диссоциации (α) имеет огромное значение для анализа, т.к. она характеризует химическую активность электролита. В зависимости от степени диссоциации все электролиты делятся на три группы: сильные, слабые и средней силы.
Склонность слабых электролитов к диссоциации характеризует константа диссоциации. Электролитическая диссоциация, как всякий обратимый процесс, приводит к химическому равновесию между недиссоциированными молекулами и ионами и должна подчиняться закону действующих масс
АВ ↔ А+ + В
Отношение произведения равновесных концентраций ионов к равновесной концентрации молекул есть величина постоянная, которую называют константой диссоциации электролита:
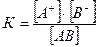 (2)
(2)
Константа диссоциации характеризует силу кислот и оснований и является справочной величиной (Приложение I).
Для сильных электролитов в отличие от слабых не используют констант диссоциации. Для оценки способности ионов к химическим взаимодействиям в растворах сильных электролитов используют термин «активность» (а). Это эффективная или условная концентрация иона, соответственно которой он действует при химических реакциях. Влияние электростатических сил на способность иона к химическим взаимодействиям характеризует коэффициент активности.
Для слабых электролитов или очень разбавленных растворов сильных электролитов активность ионов равна их концентрации. Для сильных электролитов обычно активность ионов заметно отличается от их концентрации, поэтому при точных расчетах в уравнение закона действующих масс должны входить активности ионов, а не их концентрации.
В аналитической практике обычно имеют дело со смесью ионов, концентрации которых заранее не известны, в таких случаях применять коэффициент активности нельзя. Если не требуется особая точность, вместо активностей ионов используют их действительные концентрации, диссоциацию сильных электролитов при этом считают полной.
1.2 Диссоциация воды. Водородный показатель рН. Вычисление концентрации ионов водорода [Н+] и рН в растворах кислот и оснований
Реакции, применяемые в аналитической химии, чаще всего протекают в водных растворах. Вода представляет собой слабый электролит, диссоциирующий по уравнению:
Н2О + Н2О ↔ Н3О+ + ОН-
или упрощенно:
Н2О ↔ Н+ + ОН-
Поэтому анализируемый раствор всегда наряду с ионами растворенного вещества содержит ионы Н+ и ОН-, с чем необходимо считаться при выполнении анализа.
Степень диссоциации воды очень мала. Так, при 250С в 1л воды на ионы распадается 10-7 моль Н2О (это значение было вычислено по электропроводности чистой воды). Следовательно, учитывая схему диссоциации,
[H+] = [OH-] = 10-7 моль/л.
По закону действующих масс для диссоциации воды можно записать
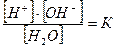 или [H+]∙[OH-] = K∙[H2O]
или [H+]∙[OH-] = K∙[H2O]
Поскольку степень диссоциации воды крайне мала, концентрацию ее недиссоциированных молекул [H2O] можно считать величиной постоянной. Следовательно, произведение [H+]∙[OH-] есть величина также постоянная, которую называют ионным произведением воды:
[H+]∙[OH-] = K 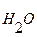 (3)
(3)
Так как при t = 250C в чистой воде [H+] = [OH-] = 10-7 моль/л, значит,
K 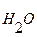 = [H+]∙[OH-] = 10-7 ∙ 10-7 = 10-14.
= [H+]∙[OH-] = 10-7 ∙ 10-7 = 10-14.
Следовательно, как бы не изменялись концентрации ионов Н+ и ОН-, их произведение во всяком водном растворе сохраняет приблизительно постоянное значение, равное 10-14 при 250С.
Среду того или иного раствора принято характеризовать концентрацией ионов водорода Н+. Различают нейтральные, кислые и щелочные растворы. Для щелочных растворов концентрацию ионов водорода Н+ находят по формуле:
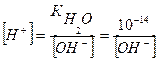 (4)
(4)
На практике среду раствора удобнее характеризовать не концентрацией ионов Н+, а водородным показателем рН:
рН = - lg [H+] (5)
Наряду с водородным показателем нередко применяют и гидроксильный показатель:
рОН = - lg [OH-] (6)
Прологарифмировав уравнение ионного произведения воды, получим:
рН + рОН = 14 (7)
На практике часто приходится вычислять рН растворов кислот и оснований, для этого предварительно нужно найти концентрацию ионов в их водных растворах.
Вычисление концентрации ионов Н+ в растворах сильных кислот.Сильная одноосновная кислота диссоциирует практически полностью по схеме:
НАn ↔ Н+ + Аn-
[H+] = Ск, (8)
где Ск – молярная концентрация кислоты (моль/л).
Сильная многоосновная кислота – диссоциация осуществляется по схеме:
НnАn ↔ nН+ + Аnn-
[H+] = n∙Cк, (9)
где Ск – молярная концентрация кислоты (моль/л).
Вычисление концентрации ионов Н+ в растворах слабых кислот.Слабая одноосновная кислота диссоциирует частично по схеме:
НАn ↔ Н+ + Аn-
Поэтому при расчете концентрации ионов учитывают константу диссоциации:
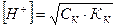 , (10)
, (10)
где Ск – молярная концентрация кислоты (моль/л); Кк – константа диссоциации.
Слабая многоосновная кислотадиссоциирует в несколько ступеней, каждая из которых имеет свою константу диссоциации. Учитывают, как правило, только первую ступень диссоциации.
I ступень: Н2Аn ↔ Н+ + НАn-
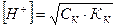 , (11)
, (11)
где Ск – молярная концентрация кислоты (моль/л); Кк – константа диссоциации по первой ступени.
Вычисление концентрации гидроксид-ионов в растворах сильных оснований (щелочей).Сильное однокислотное основание диссоциирует по схеме:
МеОН ↔Ме+ + ОН-
[OH-] = C щ, (12)
где Сщ – молярная концентрация щелочи (моль/л).
Сильное многокислотное основание:
Ме(ОН)n ↔ Меn+ + nOH-
[OH-] = n∙Cщ, (13)
где Сщ - молярная концентрация щелочи (моль/л).
Вычисление концентрации гидроксид-ионов в растворах слабых оснований.Для слабых оснований, также как и для слабых кислот, учитывают константу диссоциации. Для слабого многокислотного основания учитывается только первая ступень диссоциации:
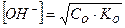 , (14)
, (14)
где Со - концентрация основания (моль/л); Ко – константа диссоциации основания по первой ступени.
Вычисление рН в растворах кислот.Водородный показатель находят по формуле:
рН = - lg [H+]
Вычисление рН в растворах оснований.Рассчитывают показатель рОН, затем находят рН:
рOН = - lg [OH-],
рН = 14 – рОН
Дата добавления: 2015-02-13; просмотров: 2211;
