Осложнения
Несостоятельность швов анастомоза является одним из наиболее тяжелых осложнений и может возникать у детей как с первичным, так и с отсроченным анастомозом пищевода. Поставить диагноз обычно несложно. Как правило, на 4-6е сутки послеоперационного периода ухудшается общее состояние больного за счет нарастания интоксикации (медиастинит), нарастает дыхательная недостаточность, По ретроплевральному дренажу начинают поступать слюна, воздух, иногда гной. Клинически и рентгенологически определяется пневмоторакс справа, пневмомедиастинум. Для того, чтобы подтвердить диагноз несостоятельности анастомоза, необходимо провести рентгенологическое обследование. Для этого, не удаляя желудочный зонд, на корень языка больного кладут второй зонд, по которому вводят водорастворимое контрастное вещество (его можно разбавить индигокармином) и делают рентгенограмму. Появление индигокармина в дренажной трубке и затек контрастного вещества в правую плевральную полость подтверждают диагноз несостоятельности анастомоза пищевода (рис.5).
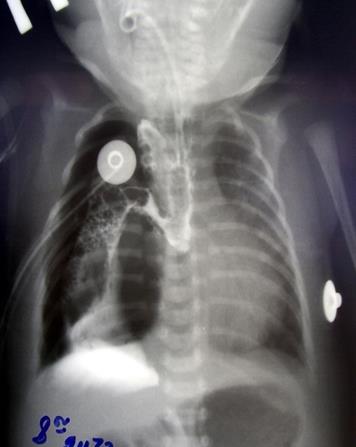
Рис. 5. Рентгенологическая картина несостоятельности анастомоза пищнвода (затек контрастного вещества в средостение и правую плевральную полость).
Это осложнение крайне жизнеопасно, поэтому требует экстренной хирургической помощи. Она заключается в том, что ребенку дополнительно дренируют средостение и правую плевральную полость (ставят второй дренаж), и, если это несостоятельность первичного анастомоза, накладывают гастростому. Следует подчеркнуть, что назогастральный зонд, поставленный во время наложения анастомоза пищевода, удалять при несостоятельности анастомоза нельзя, так как по нему, как по стенту, будет "идти" вторичное заживление анастомоза. Во время наложения гастростомы (или через имеющуюся у ребенка гастростому) через гастростомическое отверстие в тощую кишку проводят зонд для кормления, а к гастральному концу назогастрального зонда подвязывают длинную лавсановую нить, которую в дальнейшем будут использовать для бужирования пищевода после заживления анастомоза. Нить и кишечный зонд выводят через гастростомическую трубку. Роль кишечного зонда необычайно велика, так как он позволяет рано начать энтеральное питание в тощую кишка, не опасаясь рефлюкса или регургитации содержимого желудка в пищевод. В послеоперационном периоде проводят активную антибактериальную терапию, используя антибиотики широкого спектра действия и препараты, влияющие на анаэробную флору (метрогил, метронидазол). Обязательно использование иммунопротекторов, иммуномодуляторов (пентаглобин, биавен, интраглобин). Пищевод обычно заживает через 15-18 суток после возникновения несостоятельности анастомоза. После того, как прекращается отхождение содержимого по дренажным трубкам, проводят эзофагографию. При отсутствии затека контрастного вещества в средостение или попадания его в трахеобронхиальное дерево (рецидив трахеопищеводного свища), через 7-10 дней после обследования можно начинать бужирование зоны анастомоза по проводнику (нити) до полной ликвидации стеноза. Гастростому закрывают через 1,5-2 месяца после полного восстановления функции пищевода, или позже, если потребовалось длительное лечение резко выраженного стеноза анастомоза или вторично сформировавшегося ТПС.
Рецидив трахеопищеводного свища обычно возникает в раннем послеоперационном периоде, чаще всего как результат перенесенной несостоятельности анастомоза, которая не имела ярких клинических проявлений, а потому не была диагностирована. Проявления рецидивного ТПС следующие: кашель во время питья, рецидивирующая, чаще правосторонняя, среднедолевая пневмония, мигрирующие ателектазы легких. Распознать и подтвердить рецидив ТПС очень трудно. Для этого проводят фибротрахеоскопию с одновременным заполнением пищевода индигокармином. Появление красителя в трахее подтверждает диагноз ТПС. Однако, при первом обследовании не всегда удается поставить диагноз, так как свищ может быть обтурирован слизью. Поэтому отрицательный результат обследования не исключает диагноз рецидива ТПС. Нередко требуется повторение этой диагностической процедуры, причем не один раз. Определенную роль в диагностике ТПС играет рентгенологическое обследование, которое проводят следующим образом: под общим обезболиванием в пищевод больного вводят катетер Фоллея, под контролем экрана манжетку катетера раздувают в глотке (для предупреждения заброса контрастного вещества в гортань и трахею), после этого через катетер туго заполняют пищевод водорастворимым или жирорастворимым контрастным веществом (20 - 30 мл). Появление последнего в трахее или бронхах подтверждает диагноз ТПС.
В нашей практике не было ни одного случая спонтанного закрытия свища. Единственным эффективным способом лечения рецидива ТПС является хирургическое вмешательство.
Стеноз пищевода в зоне анастомоза - наиболее частое осложнение, которое проявляется в раннем возрасте затруднением глотания, частыми аспирациями. В более старшем возрасте может возникнуть обтурация пищевода пищевыми массами или инородными телами. Диагноз ставят на основании клинической картины, фиброэзофагоскопии и рентгенологического обследования с контрастным веществом (рис.6), причем в этой ситуации возможно использование бария. Лечение – бужирование пищевода.
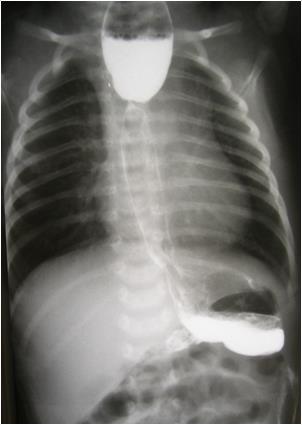
Рис.6. Стеноз зоны анастомоза пищевода.
Гастроэзофагеальный рефлюкс (ГЭР) часто отмечается у детей с АП. Причина рефлюкса недостаточно ясна. С одной стороны, натяжение мобилизованных сегментов, особенно нижнего, при наложении анастомоза может вести к укорочению интраабдоминальной части пищевода и "выпрямлению" угла Гиса. С другой стороны, в развитии ГЭР определенную роль играет врожденная дисфункция пищевода, свойственная детям с АП. Проявления рефлюкса состоят из рвоты и микроаспирации желудочного содержимого, приводящей к апноэ, рецидивирующей пневмонии, а также к частым бронхитам с астматическим компонентом. Нередко развивается эзофагит (от катарального до язвенного) и на этой почве - рецидивирующий стеноз зоны анастомоза или формирование стеноза в других отделах пищевода. Диагноз ГЭР наиболее достоверно ставится на основании суточной пищеводной рН-метрии. Большое значение имеет также рентгенологическое исследование с бариевой взвесью.
Лечение ГЭР всегда следует начинать с консервативной терапии, которая включает в себя следующие компоненты:
· медикаментозное лечение - антацидные препараты (альмагель, маалокс, фосфалюгель), прокинетики (мотилиум, координакс, церукал), в тяжелых случаях при наличии эзофагита - антисекреторные препараты (Н2-гистаминоблокаторы) и репаранты (вентер);
· позиционная терапия, особенно в ночное время - подъем головного конца кровати. При физической нагрузке (занятия физ. культурой) следует исключить физические упражнения, связанные с перенапряжением мышц брюшного пресса и длительными глубокими наклонами;
· диетотерапия с введением грудным детям «утяжелителей» грудного молока или перевод детей, находящихся на исусственном вскармливании, на питание антирефлюксными смесями («Фрисовом», «Нутрилон-антирефлюкс» и др.), пациенетам старшего возраста необходимо также исключить раздражающие продукты (сок цитрусовых, шоколад, кофе и др.);
· физиотерапевтические методы, улучшающие моторику пищевода и желудка.
Консервативные мероприятия могут оказать положительный эффект, но у детей с АП это происходит нечасто. Поэтому подход к лечению ГЭР, возникшего у ребенка с АП, должен быть несколько более активным, чем у пациентов с ГЭР, не связанном с АП и ТПС. Примерно у 15-45% больных с ГЭР и АП консервативная терапия оказывается неэффективной и требует оперативного лечения. Операцией выбора у детей с ГЭР является фундопликация по Ниссену.
Дата добавления: 2015-02-13; просмотров: 1253;
