Определение активности каталазы
(по А.Н. Баху и А.И. Опарину)
Оксидоредуктазы – класс ферментов катализирующих окислительно-восстановительные реакции. Окисление мономеров, образующихся в процессе катаболизма полимеров, представляет собой сложный многоступенчатый процесс.
Окисление веществ в клетках протекает, в основном, путем отщепления водорода (дегидрированием) или отщеплением электронов или путем присоединения кислорода к молекуле окисляемого соединения.
Акцепторами водорода у дегидрогеназ является НАД+, НАДФ, ФАД и ФМН, у некоторых флавиновых – кислород (их называют оксидазами), у гемсодержащих (пероксидаз и каталазы) – Н2О2 (пероксид водорода).
Акцепторами и переносчиками электронов являются цитохромы, содержащие гем (гемопротеины).
Каталаза (КФ 1.11.1.6) относится к гемопротеинам, катализирует процесс разрушения ядовитого для клеток пероксида водорода на воду и кислород: 2 H2O2 = 2 H2O + O2.
Для живой клетки пероксид водорода является сильным ядом, поэтому все ферменты образующие и обезвреживающие Н2О2 находятся в пероксисомах – органеллах покрытых мембраной. Главными потребителями Н2О2 являются пероксидазы (КФ 1.11.1.7.), которые окисляют фенолы, амины, некоторые гетероциклические соединения и др. субстраты дегидрированием, переносят снятые с субстратов [2Н] на Н2О2, восстанавливая его до 2 Н2О. Молекулы пероксида водорода, невостребованные пероксидазами, обезвреживаются каталазой.
Метод определения активности каталазы основан на определении количества пероксида водорода, расщепленного в процессе инкубации с ферментом. Количество H2O2 в реакционной смеси определяют титрованием в кислой среде раствором с концентрацией перманганата калия 0,02 моль/л:
5 H2O2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 +8H2O
На основании приведенного уравнения реакции можно рассчитать, что 1 мл раствора с концентрацией перманганата калия 0,02 моль/л соответствует 1,7 мг (50 мкмоль) пероксида водорода.
ХОД РАБОТЫ. 2-3 г сырого картофеля (или другого свежего растительного материала) тщательно растирают в ступке с кварцевым песком или стеклом. Для уменьшения кислой реакции добавляют на кончике скальпеля CaCO3 до прекращения выделения пузырьков СО2. В процессе растирания в ступку добавляют небольшими порциями 40-50 мл воды. Растертую массу количественно переносят в мерную колбу вместимостью 100 мл, доводят водой до метки и перемешивают. Смесь оставляют стоять 10-15 мин и после перемешивания фильтруют.
Берут две конические колбочки вместимостью 150-200 мл и вносят в них по 20 мл полученного фильтрата. Содержимое одной колбы кипятят в течение 1 мин и охлаждают до комнатной температуры (контроль). Другая колба опытная содержит активный фермент. К содержимому опытной и контрольной колб приливают по 20 мл воды и по 3 мл раствора с массовой долей H2O2 1 %. Содержимое тщательно перемешивают и оставляют при комнатной температуре на 30 мин. По окончании инкубации в обе колбы добавляют по 5 мл раствора с массовой долей серной кислоты 10 %, перемешивают и избыток H2O2 в каждой колбе оттитровывают раствором с концентрацией перманганата калия 0,02 моль/л до образования розового окрашивания, не исчезающего в течение 1 мин.
Активность каталазы выражают в мкмоль пероксида водорода, расщепившегося под действием фермента в расчете на 1 г исследуемого материала (или на 1 мг вытяжки из него) за 1 мин. Вычисление ведут по формуле:
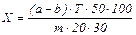 ,
,
где Х – активность каталазы, Е/г;
(а-b) – разность между объемами раствора с концентрацией перманганата калия 0,02 моль/л, пошедшего на титрование контрольной (а) и опытной (b) проб, мл;
Т – титр примененного для титрования раствора перманганата калия;
50 – коэффициент пересчета на мкмоль H2O2;
100 – общий объем приготовленного экстракта;
m – масса взятого для анализа материала, г;
20 – объем фильтрата, взятого для анализа, мл;
30 – время инкубации, мин.
Принцип определения, порядок анализа и результат анализа записывают.
Активность каталазы можно определить и по объему кислорода, выделившегося после прибавления к исследуемому объекту H2O2.
Этот принцип используют для определения активности каталазы в молоке, выражаемую каталазным числом, представляющим собой объем кислорода (мл) выделившийся за 2 часа при 25 °С из добавленных к 15 мл молока 5 мг раствора с массовой долей H2O2 1 %. Молоко, полученное от здоровых животных, выделяет 0,7-2,5 мл кислорода, т.е. каталазное число натурального молока составляет не более 2,5. Молоко, полученное от больных животных (мастит и др.), и молозиво имеют повышенные каталазные числа, достигающие до 15.
РЕАКТИВЫ. Вода дистиллированная; кальций углекислый (порошок); раствор с концентрацией перманганата калия 0,02 моль/л; растворы с массовыми долями: пероксида водорода 1 % (10 мл раствора с массовой долей H2O2 30 % разбавить водой до 300 мл), серной кислоты 10 %.
КОНТРОЛЬНЫЕ ВОПРОСЫ.
1. Основные пути окисления субстратов в клетке.
2. Характеристика строения и действия НАД+- и НАДФ-зависимых дегидрогеназ.
3. Характеристика строения и действия ФАД-зависимых дегидрогеназ.
4. Какие ферменты называют оксидазами? Их кофакторы.
5. Характеристика строения и действия пероксидаз и каталаз.
6. Характеристика строения и действия цитохромов.
7. Химизм, образование и пути обезвреживания пероксида водорода в клетках.
8. Метод определения активности каталазы.
Дата добавления: 2015-02-13; просмотров: 7455;
