Разделение смеси аминокислот методом хроматографии на бумаге
Хроматография является эффективным методом для решения одной из важнейших задач биохимии – разделения и идентификации химических соединений (белков, аминокислот, жирных кислот, моно- и дисахаридов и др.). Метод предложен в 1903 г. профессором Воронежского университета М.С. Цветом для разделения растительных пигментов.
В настоящее время известно большое число различных видов хроматографии (распределительная, адсорбционная, ионообменная, на молекулярных ситах) и различных приемов их применения (на бумаге, колоночная, тонкослойная, газовая). Современные разновидности хроматографии, различающиеся по технике выполнения позволяют быстро разделить отдельные компоненты из небольшого количества сложной смеси.
Принцип распределительной хроматографии состоит в том, что вещества помещают в систему, которая содержит два физически различных компонента- подвижную и неподвижную фазы. Неподвижную (стационарную) фазу называют сорбентом. Если сорбентом служит жидкость, удерживаемая каким-либо твердым телом, то это тело называют носителем или матрицей. Подвижную фазу называют растворителем или проявителем; компоненты разделяемой смеси – растворенными веществами. В варианте распределительной хроматографии на бумаге носителем служит целлюлоза в виде листов хроматографической бумаги. Неподвижной фазой служат пары воды, насыщающие лист этой бумаги при данных условиях. В качестве подвижной фазы применяют насыщенный водой органический растворитель, который, двигаясь по бумаге, растворяет и увлекает за собой нанесенный образец.
Распределительная хроматография основана на том, что растворенное вещество распределяется между подвижной и неподвижной фазами. Этот процесс называется распределением и количественно описывается коэффициентом распределения, представляющим собой отношение концентраций растворенного вещества в каждой из двух фаз. Рассчитывают этот коэффициент по следующей формуле:
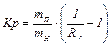 ,
,
где, mп – масса подвижной фазы;
mн – масса неподвижной фазы;
Rf – коэффициент подвижности (скорости перемещения зоны компонента).
По мере движения растворителя происходит множество микроскопических актов распределения каждого из исследуемых компонентов между подвижной и неподвижной фазами, в результате чего вещества с разными коэффициентами распределения оказываются на различном расстоянии от старта.
Коэффициентом Rf (подвижности) называют отношение расстояния от места нанесения исследуемого вещества до середины пятна (а) к расстоянию, от места нанесения вещества до фронта растворителя (в): Rf = а/в. Каждое из разделяемых веществ имеет свой Rf. Этот коэффициент может быть использован для идентификации (определения) компонентов исследуемой смеси, но воспроизводимость его зависит от условий опыта (температура, сорт бумаги, чистота растворителя, однотипность процедур и др.).
Существуют различные виды хроматографии на бумаге: нисходящая (растворитель движется по бумаге сверху вниз), восходящая (растворитель движется по бумаге снизу верх), круговая (движение растворителя происходит от центра круга к периферии) и др. В учебных целях наиболее удобна круговая (радиальная) хроматография.
Все операции с хроматографической бумагой проделывают тщательно вымытыми перед работой руками или в чистых резиновых перчатках. Надписи на бумаге делают простым карандашом.
 ХОД РАБОТЫ. Работа состоит из нескольких этапов, которые выполняются в определенной последовательности:
ХОД РАБОТЫ. Работа состоит из нескольких этапов, которые выполняются в определенной последовательности:
1.Разметка и маркировка хроматографической бумаги. Из хроматографической бумаги вырезают квадрат со стороной на 0,5 см больше диаметра используемой для работы чашки Петри (рис.3).
 Двумя перпендикулярными линиями, проведенными карандашом через центр, квадрат делят на четыре сектора. По краю каждого сектора делают простым карандашом надпись о наносимом веществе.
Двумя перпендикулярными линиями, проведенными карандашом через центр, квадрат делят на четыре сектора. По краю каждого сектора делают простым карандашом надпись о наносимом веществе.
На взаимно перпендикулярных прямых, отступив от центра 1,5 см к краю каждой стороны квадрата, сделать карандашом метки (1). Это будет место для нанесения пробы (стартовая линия).
2. Нанесение растворов. В отмеченные точки микропипеткой наносят растворы аминокислот (в соответствии с надписью) или смесь в объеме 0,002-0,01 мл. Нанесение осуществляют прикосновением острого конца заполненной микропипетки к бумаге в отмеченную точку и быстром ее поднятии. При этом на бумаге должно оставаться пятно диаметром не более 3-4 мм. После полного подсыхания пятна операцию повторяют. Так поступают до тех пор, пока весь раствор из микропипетки не будет перенесен на отмеченную точку (стартовую линию).
В центре хроматограммы просверливают отверстие (2) и в него вставляют фитилек (трубочку, скрученную из хроматографической бумаги). Фитилек (3) должен плотно прилегать к краям отверстия, высота его должна быть несколько меньше, чем внутренняя высота камеры.
3. Приготовление растворителя. В колбу объемом 100 мл приливают бутанол, уксусную кислоту и воду в соотношении 12:3:5 и тщательно перемешивают. Полученный раствор наливают в одну из половин чашки Петри по 15-20 мл, приготовленного для разделения смеси аминокислот.
4. Разгонка аминокислот. Хроматограмму укладывают на половинку чашки так, чтобы фитилек располагался в центре и касался ее дна. Для уменьшения испарения растворителя хроматограмму накрывают второй половиной чашки, добиваясь совмещения краев чашек.
Насыщенный неподвижной фазой растворитель по фитильку непрерывно поступает к центру хроматограммы и, двигаясь к краям, растворяет нанесенные аминокислоты и увлекает их за собой. При этом каждая из аминокислот движется по слою бумаги с определенной скоростью, что обусловлено коэффициентом распределения. Скорость аминокислот неодинакова, так как зависит от степени их растворения в неподвижной и подвижной фазе растворителя. Аминокислоты с полярными незаряженными, отрицательно и положительно заряженными (гидрофильными) радикалами движутся медленно, вместе с водой, некоторые чуть впереди воды. Аминокислоты с неполярными, гидрофобными радикалами перемещаются быстрее, так как вода, продвигаясь по бумаге, выталкивает их, а бутилово-уксусная фракция – увлекает за собой. Скорость перемещения аминокислот одновременно зависит от величины и объема радикала.
После того как растворитель дойдет почти до краев чашки, хроматограмму снимают, удаляют фитилек, простым карандашом проводят линию между сухой и мокрыми зонами бумаги (отмечают границу фронта растворителя) и высушивают в вытяжном шкафу.
5. Проявление. Хроматограмму смачивают в налитом в ванночку растворе с массовой концентрацией нингидрина в ацетоне 1 %, вновь высушивают в вытяжном шкафу и помещают для развития окраски пятен аминокислот на 1,5-2 мин в сушильный шкаф при температуре 100 °С или прогревают над плиткой до полного развития окраски комплексов аминокислот с нингидрином.
6. Определение коэффициента подвижности аминокислот. Описывают кратко принцип метода бумажной хроматографии, определяют Rf аминокислот-метчиков и аминокислот смеси, идентифицируют аминокислоты смеси, хроматограмму зарисовывают. Замеряют расстояние, пройденное каждой аминокислотой от точки старта до середины пятна (а), и расстояние пройденное растворителем в данном секторе (в). По формуле рассчитывают коэффициент подвижности:
Rf = а/в.
7. Идентификация аминокислот, содержащихся в смеси, осуществляется по совпадению их позиций с позицией аминокислот-метчиков на хроматограмме, по совпадению коэффициентов подвижности и по однородности окраски пятен.
Rf для аминокислот при разделении на бумаге растворителем, состоящим из бутанола, уксусной кислоты и воды в соотношении 12:3:5 приведены в табл.7.
Таблица 7.
Коэффициенты подвижности аминокислот (Rf)
| Аминокислоты | Rf | Аминокислоты | Rf | Аминокислоты | Rf |
| Цистеин | 0,08 | Оксипролин | 0,22 | Тирозин | 0,45 |
| Гистидин | 0,11 | Глицин | 0,23 | Триптофан | 0,50 |
| Лизин | 0,12 | Аспарагиновая | 0,23 | Метионин | 0,50 |
| Аспарагин | 0,12 | Треонин | 0,26 | Валин | 0,51 |
| Глутамин | 0,17 | Глутаминовая | 0,28 | Фенилаланин | 0,60 |
| Аргинин | 0,15 | Аланин | 0,30 | Изолейцин | 0,67 |
| Серин | 0,22 | Пролин | 0,34 | Лейцин | 0,70 |
Хроматографический метод позволяет произвести и количественное определение аминокислот в смеси. Для этого пятна аминокислот смеси и аминокислот-метчиков обводят карандашом, нумеруют, вырезают, делают в них надрезы и помещают в пробирки с соответствующим пятну номером.
Затем в пробирки наливают по 3 мл насыщенного сульфатом меди раствора с объемной концентрацией этанола 80 %, содержимое в пробирках перемешивают и ставят в темное место на 30 мин (каждые 10 мин содержимое пробирок перемешивают). Окраска с бумаги переходит в раствор этанола с образованием медных производных сине-фиолетового Руэмана, окрашенных в красный цвет. Оптическую плотность окрашенных растворов аминокислот-метчиков и аминокислот смеси измеряют при 540 нм (зеленный светофильтр) на ФЭКе против насыщенного сульфатом меди раствора с объемной концентрацией этанола 80 %. Массовую концентрацию каждой аминокислоты в смеси рассчитывают по формуле:
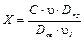 ,
,
где, Х – массовая концентрация аминокислоты в исследуемой смеси, мг/мл;
С – массовая концентрация аминокислоты-метчика (свидетеля), мг/мл;
u - объем нанесенного на хроматограмму раствора аминокислоты-метчика, мл;
u1 - объем нанесенного на хроматограмму раствора исследуемой смеси, мл;
Dпр – оптическая плотность раствора с пятна аминокислоты смеси;
Dсв – оптическая плотность раствора с пятна аминокислоты метчика.
Результаты расчетов по количественному составу аминокислот смеси записывают и делают окончательный вывод по всей работе.
РЕАКТИВЫ. Хроматографическая бумага; вода дистиллированная; органический растворитель (бутанол, ледяная уксусная кислота, вода в соотношении по объему 12:3:5); этанол; раствор с массовой концентрацией нингидрина в ацетоне 1 %; смесь аминокислот (взвешивают по 10 мг лизина, аланина и лейцина, смешивают вместе и растворяют в 10 мл раствора с объемной концентрацией этанола 80 %, при отсутствии какой-либо из аминокислот для приготовления смеси можно взять другие аминокислоты с существенно отличающимися величинами Rf); растворы аминокислот-метчиков, или «свидетелей» (10 мг каждой из аминокислот, взятых для приготовления смеси, растворяют в отдельных флаконах в 10 мл раствора с объемной концентрацией этанола 80 %); раствор с объемной концентрацией этанола 80 % насыщенный сульфатом меди.
КОНТОРОЛЬНЫЕ ВОПРОСЫ.
1. Общая характеристика метода хроматографии и ее роль в биохимии.
2. Назовите основные виды хроматографии.
3. Общая характеристика принципа хроматографии.
4. Назовите разновидности метода хроматографии на бумаге и чем они отличаются.
5. Назовите основные этапы радиальной хроматографии на бумаге.
6. Техника разметки и маркировки хроматографической бумаги.
7.Техника нанесения растворов в точки старта.
8. Состав и техника приготовления растворителя для «разгонки» аминокислот на бумаге.
9. От чего зависит скорость движения аминокислот в процессе хроматографии.
Проявление аминокислот.
10. Как рассчитывается коэффициент подвижности (Rf) и что он характеризует?
11. Что такое «идентификация аминокислот» и как её проводят.
12. Назовите основные этапы количественного определения аминокислот методом хроматографии на бумаге.
13. Техника экстрагирования окрашенных пятен.
14. Как определяется содержание аминокислот в 1 мл смеси.
Дата добавления: 2015-02-13; просмотров: 11634;
