НАРУШЕНИЯ КИШЕЧНОГО ПИЩЕВАРЕНИЯ
Пищеварение в кишечнике здоровых животных обеспечивается его секреторной, моторной, всасывающей, экскреторной и инкреторной функциями. Кишечное пищеварение осуществляется путем внутриполостного и пристеночного гидролиза белков, жиров и углеводов корма. Внутриполостное пищеварение определяется энзимами поджелудочной железы, кишечного сока, желчью, ферментативной активностью симбионтной микрофлоры. Мембранный гидролиз осуществляется ферментами энтероцитов.
Нарушение секреции поджелудочной железы. Причины нарушений внешней секреции поджелудочной железы: затруднение выведения панкреатического сока в двенадцатиперстную кишку из-за сдавливания протока извне или его закупорки; уменьшение образования секретина, стимулирующего продукцию ферментов; снижение тонуса секреторного блуждающего нерва; поражение железы воспалительным процессом (острые, хронические панкреатиты), опухолью; аллергические и аутоаллергические реакции; острые отравления (свинец, ртуть, фосфор).
Расстройство пищеварения определяется дефицитом ферментов, входящих в состав панкреатического сока. Протеазы поступают в кишечник в неактивной форме. Энтерокиназа, содержащаяся в кишечном соке, активирует трипсиноген, превращает его в активный фермент — трипсин. Трипсин, в свою очередь, превращает остальные пептидазы (химотрипсин, эластаза, карбоксипептидаза, калликреин) в активные формы. Недостаток протеолитических ферментов поджелудочной железы снижает эффективность использования белков корма, до 60—70 % непереваренного протеина выводится из организма.
Отсутствие или недостаток поджелудочной липазы приводит к тому, что значительная часть жира не усваивается и выделяется с фекальными массами (стеаторея).
Недостаточное содержание амилазы ведет к потере крахмала, его непереваренные зерна обнаруживаются в фекалиях больных животных.
Затруднение в выходе секрета, повышение давления в протоке поджелудочной железы, попадание туда желчи, содержащей энтерокиназу, могут привести к самоперевариванию (аутолиз) ткани железы активированными протеолитическими ферментами.
Аутолиз ткани железы сопровождается образованием большого количества биологически активных веществ, поступающих в кровоток. Пептидазы, кинины, лизолецитин, другие соединения вызывают тяжелые расстройства нервной регуляции, сердечной деятельности, гемодинамики, дыхания, приводящие к панкреатическому шоку.
Нарушение выделения желчи. Функции желчи многообразны. В ее состав входят желчные кислоты (холевая, хенодезоксихолевая), желчные пигменты (билирубин), жирные кислоты, холестерин, лецитин. Желчеобразование стимулирует блуждающий нерв и гуморальные факторы — гастрин, секретин, хлористоводородная кислота, прием богатого белками и жиром корма. Активация симпатического нерва и голодание тормозят образование и выведение желчи.
К этиологическим факторам, определяющим недостаточное поступление желчи в кишечник, относят воспаление желчного пузыря (холецистит), дискинезию желчных протоков, желчнокаменную болезнь, гепатит, гепатоз, цирроз печени. Затруднения в оттоке желчи могут возникнуть из-за сдавливания выводящих путей опухолями, наличия в их просвете паразитов (фисциолез крупного рогатого скота, описторхоз плотоядных).
Снижение выделения желчи (гипохолия) или полное прекращение ее поступления в кишечник (ахолия) приводят к нарушениям кишечного пищеварения. В наибольшей степени расстраивается усвоение жира. Он не подвергается эмульгированию желчными кислотами, поджелудочная липаза не активируется, жирные кислоты не образуют с желчными кислотами водорастворимых комплексов. Организм не получает необходимого количества липидов, жирорастворимых витаминов, холестерина. Недостаток желчи негативно сказывается и на усвоении белка, углеводов. Клеточная мембрана представляет в своей основе билипидный слой, поэтому белки и углеводы без разрушения мембран не могут быть объектом воздействия протеолитических и амилолитических ферментов. Кроме того, желчь, нейтрализуя желудочное содержимое, поступившее в кишечник, создает оптимальные условия для ферментов дуоденального сока, ее недостаточность ингибирует активность протеаз и амилаз. Дефицит желчи негативно отражается на пристеночном пищеварении, поскольку снижена адсорбция энтероцитами ферментов химуса.
Желчные кислоты, воздействуя на хеморецепторы, стимулируют перистальтику и обладают бактерицидностью.
Гипо- и ахолия сопровождаются гипокинезией кишечника, усилением процессов брожения, гниения, газообразования. Развивается интоксикация.
Нарушение секреторной функции кишечника. В просвет кишечника выделяют свои секреты брюннеровы железы, расположенные в подслизистой оболочке двенадцатиперстной кишки, либеркюновые железы и бокаловидные клетки. Основными же источниками ферментов кишечного сока являются эпителиоциты слизистой оболочки. Слущиваясь с вершины ворсинки, они представляют собой комок слизи с обилием энзимов: пептидаз, гликозидгидролаз, кишечной липазы, щелочной фосфатазы, энтероки-назы. Переваривающая способность кишечного сока и активность отдельных ферментных систем имеют возрастные и видовые особенности. Так, активность кишечной мальтазы у жвачных почти в 50 раз ниже, чем у свиней. Молодняк млекопитающих остро переносит недостаток лактазы — фермента, обеспечивающего гидролиз молочного сахара — лактозы. Этот дефект наблюдают у гипотрофичных, физиологически незрелых молодых животных (телят, поросят). Лактоза становится достоянием микрофлоры толстого кишечника, ферменты которой гидролизуют молочный сахар до молочной, пировиноградной, уксусной кислот. Эти кислоты осмотически активны. Их появление в избыточном количестве способствует развитию диареи, интоксикации организма.
Недостаток «фермента ферментов» энтерокиназы ингибирует превращение трипсиногена в трипсин, сказывается на усвоении белка организмом.
Полостное кишечное пищеварение обеспечивает разрушение тканевых и клеточных структур корма, разрыв химических связей в молекулах биополимеров. Образовавшиеся промежуточные продукты элиминируются в зону щеточной каймы энтероцитов, на мембранах которых гидролиз завершается образованием конечных продуктов, чаще всего в виде мономеров. Этот процесс получил название мембранного (пристеночного) пищеварения.
На мембранах энтероцитов молекулы передаются с гидролитических на транспортные системы кишечной клетки. Оттуда они поступают в лимфатические и кровеносные сосуды ворсинки, а, затем в общий лимфо- и кровоток. Таким образом, гидролиз завершается всасыванием.
Ферменты, участвующие в пристеночном пищеварении, двоякого происхождения. Одни из них, преимущественно панкреатические, адсорбируются на поверхности щеточной каймы (альфа-амилаза, липаза, трипсин, химотрипсин, эластаза), другие ферменты — энтерального происхождения. Поэтому дефекты мембранного гидролиза и последующего транспорта (всасывания), зависят от количества и активности ферментов панкреатического: сока, а также от патологических изменений структуры и ультраструктуры кишечной поверхности. Такие изменения обнаружены, у животных после оперативных вмешательств на желудочно-кишечном тракте, при кишечной непроходимости, заболеваниях печени, многих инфекционных болезнях и болезнях паразитарного происхождения. Существенно нарушаются мембранное пищеварение и всасывание при лучевой патологии, воздействии эмоционального стресса, гиповитаминозах, нарушениях обмена веществ. Так, обнаружено, что у коров, страдающих остеодистрофией, пептидазная активность слизистой оболочки существенно подавлена. У родившихся от них телят, больных диспепсией (простая и токсическая), значительно уменьшен синтез основных ферментов энтероцитами, снижена скорость транслокации энзимов на наружную поверхность мембраны кишечного эпителия. Показано, что: диспепсия у новорожденных телят обусловлена прежде всего нарушением мембранного пищеварения.
Опытами на овцах выявлена регулирующая роль в мембранном пищеварении вегетативной нервной системы и ретикулярной формации мозга, стимулирующей или тормозящей процессы гидролиза в тонкой кишке. Заражение овец ассоциацией кишечных нематод трех родов сопровождалось ингибицией активности трипептидазы, мальтазы и щелочной фосфатазы при полисубстратном мембранном гидролизе. После дегельминтизации активность гидролаз повышалась.
При многих заболеваниях нарушение во взаимоотношениях пищеварительных и транспортных функций эпителия тонкой кишки возникает в ее проксимальных отделах. Поражение последних, например, за счет токсических веществ, поступающих с кормом (соли тяжелых металлов), приводит к тому, что дистальная область как резервная зона становится главной в гидролизе и ассимиляции компонентов корма. Найдено, что период молочного питания у всех млекопитающих характеризуется редукцией резервной зоны и именно этот период является наиболее неустойчивым в пищеварении. Дистальная локализация многих кишечных ферментов в молочный период определяет повышенную чувствительность молодняка к некомпенсируемому дефекту пищеварительно-транспортных комплексов. Воспалительные процессы в кишке телят сопровождаются 2—3-кратным повышением гидролитической активности содержимого дистальной части тонкой кишки по отношению к проксимальной при противоположной тенденции у здоровых животных.
Сопряженность гидролиза и транспорта в процессе мембранного пищеварения зависит не только от активности адсорбированных ферментов, транслокации энзимов на наружную поверхность мембраны микроворсинок энтероцитов, но и от ряда других факторов. К наиболее значимым следует отнести застойные явления, гипоксию, недостаточное восстановление макроэнергетических комплексов, повышенную проницаемость сосудистых стенок при энтеритах, снижение, усиление или отсутствие перистальтики кишечника, блокаду ферментов токсинами разного происхождения, аутоиммунные поражения энтероцитов, паразитозы, дисбактериоз и др.
Нарушение двигательной функции кишечника. Перистальтические движения кишечника под влиянием различных причин могут усиливаться (гиперкинез), замедляться (гипокинез) или прекращаться (акинез). Нарушения моторной функции кишечника могут касаться и их сегментирующих (ритмичная сегментация, маятникообразные движения) сокращений, направленных на перемешивание содержимого.
Ускорение перистальтики возникает под влиянием повышения тонуса эфферентных парасимпатических нервных волокон, стимулирующих моторику выделением медиатора ацетилхолина, взаимодействующего с вегетативными ганглиями и холинреактивными структурами гладких мышц кишечной стенки. Эта патологическая эфферентная импульсация — ответная реакция на эмоциональный стресс (диарея у рысистых лошадей, выходящих на старт), раздражение рецепторного аппарата слизистой оболочки грубыми, непереваренными частицами корма, продуктами избыточного брожения, гниения при дисбактериозе. Нередко причины ускоренной перистальтики кишечника у животных разных видов — инфекции, поражающие преимущественно желудочно-кишечный тракт, такие, как колибактериоз, паратиф, вирусный энтерит телят, парвовирусный энтерит собак и др.
На почве инфекции, инвазии, поедания недоброкачественных кормов, расстройств нервной и эндокринной регуляций возникают энтериты (воспаление слизистой оболочки тонкого кишечника), колиты (воспаление слизистой оболочки толстого кишечника), гастроэнтериты, энтероколиты.
Воспалительные процессы сопровождаются повышением двигательной функции кишок, ускорением перемещения их содержимого от проксимальной части к дистальной, ухудшением переваривания и всасывания, поносом (diarrhoea). Диарея характерна болевым синдромом за счет спазма и тонических сокращений кишечника, частой дефекацией жидкими фекальными массами. Усиление перистальтики и освобождение организма от токсических продуктов, поступивших с кормом или эндогенного происхождения, имеет защитное значение. Однако продолжительные поносы приводят к обезвоживанию организма, гиповолемии, аутоинтоксикации, снижению продуктивности, истощению. Особенно опасна диарея для молодняка сельскохозяйственных животных. Обезвоживание, потеря пластических и энергетических источников существования, электролитов, аутоинтоксикация нередко сопровождаются гибелью телят, поросят, ягнят, щенков собак, пушных зверей.
Замедление перистальтики наблюдают как результат преобладания симпатической иннервации, усиленного выброса адреналина и норадреналина или понижения тонуса кишечной стенки. Поэтому возникающие запоры кишечника (constipatio intestini) подразделяют на спастические и атонические.
Спастические запоры обусловлены длительным сокращением мышц кишечника под влиянием эмоционального стресса, депрессивных состояний, висцеро-висцеральных патологических рефлексов.
Атонические запоры возникают чаще. Их происхождение может быть алиментарного характера: в связи с уменьшением количества принимаемого корма, недостатка клетчатки как физиологического раздражителя кишечных механорецепторов. Запоры сопровождают гиперсекрецию желудочного сока, гипо- или ахолию, перитонит, снижение аппетита, сопутствующее многим заболеваниям.
Моделировать запоры можно введением животным атропина, настойки опия, денервацией кишечника.
Замедление перистальтики сопровождается застоем содержимого в тонком или толстом кишечнике, снижением секреции кишечного сока, ингибицией его ферментативной активности и мембранного пищеварения. Вследствие длительного застоя содержимое кишечника обезвоживается, превращается в уплотненные массы. Такой процесс, происходящий в тонком кишечнике, получил название химостаза, а в толстом — копростаза. Копростазы часто наблюдают у лошадей в слепой, большой и малой ободочной кишках. Заболевание возникает как следствие длительного скармливания концентратов при ограничении грубых кормов.
Кишечная непроходимость. Непроходимость кишечника — илеус (от греч. eileo — запираю, скручиваю) наблюдают у продуктивных животных всех видов. Заболевание характеризуется прекращением дистально-проксимального перемещения содержимого кишечника, его брожением и гниением с обильным образованием токсических, в том числе газообразных, веществ, болевым синдромом, аутоинтоксикацией.
Рассматривают три формы непроходимости кишечника у животных: динамическую, механическую, тромбоэмболическую.
Динамическая непроходимость обусловлена функциональными расстройствами нервно-мышечного аппарата кишечной стенки. Возможно развитие спастической формы как результат длительного сокращения мышечных элементов стенки кишок, в частности у лошадей при ревматической форме энтералгии. Противоположная форма динамической непроходимости — паралитическая. Паралич кишечных мышц возможен при перитонитах, травмах брюшной полости, оперативных вмешательствах на этих органах.
Механическая непроходимость у животных встречается наиболее часто. Она может быть результатом закупорки (обтурации) просвета кишечника безоарами (рис. 30), уплотненным содержимым (химо- и копростаз), кишечными камнями, особенно у лошадей, паразитами (аскаридоз свиней), отечной тканью при воспалениях разного генеза, опухолью, гематомой стенки кишки. Механическим препятствием могут быть ущемленная в грыжевом мешке петля кишки, инвагинация, перекручивание кишок вокруг брыжейки, особенно у свиней, образование связок и соединительнотканных тяжей. Возможны врожденные аномалии развития, ведущие к непроходимости кишечника (отсутствие анального отверстия).
Тромбоэмболическая (гемостатическая) непроходимость кишечника встречается как результат тромбоза или эмболии ее сосудов. Происхождение эмболов различно. Это могут быть личинки паразитов, опухолевые клетки, тромбические массы. У лошадей нередкая причина тромбоэмболической непроходимости — личинки делафондий, которые повреждают брыжеечные артерии. От образующегося рыхлого тромба легко отрываются частицы, током крови они переносятся в нижележащие артерии, вызывают их эмболию с последующим некрозом соответствующего сегмента кишки. Перистальтика прекращается, возникает непроходимость.
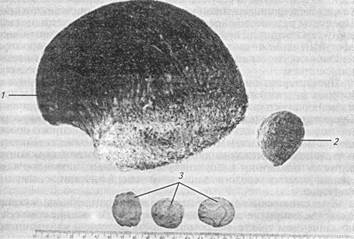
Рис. 30. Конкременты желудочно-кишечного тракта у животных:
1- распил пилоконкремента, извлеченного из желудка свиньи; 2- трихобензоар из сычуга овцы; 3- энтеролиты из кишечника лошади
Патогенез кишечной непроходимости в начальной стадии развития обусловлен этиологическим фактором. Однако вслед за прекрашением перемещения содержимого кишок проявляются общие закономерности развития данного вида патологии. Содержимое кишечника выше места препятствия начинает подвергаться усиленному брожению и гниению. Образуется избыточное количество токсических продуктов, газов. Токсины раздражают рецепторные образования слизистой оболочки кишок, газы быстро ведут к перерастяжению кишечной стенки, раздражению бароре-цепторов. Патологическая импульсация перевозбуждает центральную нервную систему. Возникает ощущение резкой боли, проявляющееся у животных симптомокомплексом колик. Падает артериальное давление. Возможно развитие рвоты. При продолжающейся секреции кишечного сока всасывание резко снижается. Рвота ведет к потере воды, ионов калия, натрия, хлоридов, гидрокарбонатов. Обезвоживание сопровождается гиповолемией, гипотензией, аутоинтоксикацией. Потеря желудочного содержимого способствует развитию алкалоза, что усугубляет атонию.
Непосредственно в очаге непроходимости прогрессирует ишемия в случае эмболии артерий или венозная гиперемия, обусловленная затруднением оттока крови и лимфы (тромбоз, заворот петли кишки). В том и другом случае гипоксия сопровождается повышением проницаемости сосудов пораженной кишечной стенки. В избытке образующиеся продукты гниения (индол, скатол, крезол, фенол, аммиак) из полости кишки поступают в кровь. Продукты развивающейся некротизации кишечной стенки (гиста-мин, серотонин) и аутолиза усугубляют интоксикацию. Смерть наступает либо от шока, вызванного интоксикацией, либо от асфиксии как следствия сдавливания легких переполненным газами кишечником.
Дисбактериоз кишечника. В раннем постнатальном периоде кишечник животных заполняется микрофлорой. Ее состав, несмотря на меняющиеся условия внешней среды, относительно постоянен. Существует определенная закономерность расселения микроорганизмов в разных отделах кишечника и количественного соотношения между представителями микробов разных видов. Динамичное равновесие между микрофлорой и макроорганизмом контролируется последним с помощью механических, химических, неспецифических средств защиты и специфических иммунных факторов.
К механическим относят перистальтику кишечника, мукопротеиновое покрытие эпителия, его быстрое обновление в желудочно-кишечном тракте, непроницаемость щеточной каймы энтероцитов.
Химические факторы представлены хлористоводородной кислотой желудочного сока, пепсином, трипсином, желчными кислотами, кишечным соком.
Местная защита кишечника включает в себя неспецифические факторы, такие, как лизоцим, комплемент, интерферон, лактоферрин, и специфические, обусловленные клеточными (Т-система) и гуморальными (В-система) факторами. В пищеварительном тракте присутствуют различные популяции иммунокомпетентных клеток. Очень важную роль играет секреторный иммуноглобулин A(IgA).
Фактор колонизационной резистентности, способности сопротивляться колонизации кишечника условно-патогенными микроорганизмами представляет собой анаэробную флору, населяющую кишечник. Анаэробные бактерии, такие, как бифидобактерии и бактериоиды, контролируют состав условно-патогенных микроорганизмов (клебсиеллы, энтеробактер, протей, стафилококки и др.), которые, заселяя толстый отдел кишечника, могут являться основным источником эндогенной инфекции.
К важнейшим для организма функциям нормальной (эубиотической) микрофлоры относят:
ü защитную, антагонистическую по отношению к патогенной и условно-патогенной флоре;
ü ферментативную, проявляющуюся расщеплением клетчатки, крахмала, остатков белка и жира с образованием всасывающихся веществ, газов, органических кислот, усиливающих перистальтику кишечника;
ü синтетическую, выражающуюся в синтезе витаминов (группы В, К, никотиновой и аскорбиновой кислот), аминокислот, холестерина, других соединений;
ü иммунизирующую, ибо под влиянием микрофлоры кишечника формируется и сохраняется в активном состоянии иммунокомпетентная система, ответственная за клеточные защитные реакции, образование иммуноглобулинов.
У 14-дневных телят общее число микроорганизмов в фекалиях было в 9,6 раза больше, чем у однодневных. Эти важнейшие функции микроорганизмов-симбионтов могут быть нарушены. Изменение нормальной флоры кишечника, ее качественных и количественных характеристик, мест обитания называют дисбактериозом.
Дисбактериоз — ведущий синдром при многих формах патологии тонкого и толстого кишечника. Для дисбактериоза характерно увеличение содержания микроорганизмов в тонкой кишке с преобладанием эшерихий, лактобацилл, энтерококков, бактерий рода Klebsiella. В фекалиях уменьшается количество или отсутствуют совсем бифидобактерии, но существенно увеличивается количество стрептококков, стафилококков, протея, эшерихий, дрожжевых грибов, бактерий рода Klebsiella.
Причинами дисбактериоза кишечника являются заболевания желудка (ана-, гипацидный гастрит), нарушение моторной функции кишечника (запоры, поносы, непроходимость), голодание (полное, неполное, частичное), лекарственные средства (антимикробные препараты, антибиотики), воздействие ионизирующей радиации, аллергия, воспалительные и инфекционные заболевания, повреждающие кишечник.
Дисбиотическая микрофлора вызывает расстройство пищеварения, является источником всасывающихся токсических веществ, газообразных продуктов, вызывающих метеоризм. Метаболиты и токсины бактерий подавляют дезинтоксикационную функцию печени, повышают проницаемость кишечной стенки, ингибируют регенерацию эпителия, во многом определяют развитие диспептического синдрома.
Дисбактериоз может какое-то время протекать бессимптомно, но при снижении общей резистентности, упадке защитных сил организма проявляются свойственные ему признаки.
Выделяют следующие формы дисбактериоза:
Ø латентную (компенсированную), когда дисбактериоз можно обнаружить лишь по бактериологическому анализу кишечной микрофлоры;
Ø субкомпенсированную форму, характеризующуюся распространенным (энтерит, колит) или локальным (дуоденит) воспалительным процессом. При обострении возникает склонность к генерализации с прорывом основных барьеров (кишечный эпителий, лимфатический барьер, печень), токсемии, кратковременной бактериемии;
Ø декомпенсированную форму с генерализацией дисбактериоза, появляющуюся в связи с нарушением функциональных барьеров, снижением общей резистентности организма. Возникают метастатические воспалительные очаги, выражены интоксикация, бактериемия с возможным переходом в сепсис.
По преобладанию того или иного вида микроорганизма рассматривают параколидисбактериоз, для которого характерно появление необычных, в том числе гемолизирующих, штаммов кишечной палочки; протейный, энтерококковый, стафилококковый, дрожжевой, ассоциированный, с участием нескольких условно-патогенных микроорганизмов, дисбактериозы.
Дисбактериоз может быть первичным в кишечной патологии и вторичным. При первичном вначале активируется дисбиотическая микрофлора, а затем возникает воспаление слизистой оболочки кишечника. Вторичный дисбактериоз появляется как осложнение возникшего ранее заболевания (лучевая патология, аллергия) кишечника.
Дисбактериоз сопровождается недостаточностью пищеварения, всасывания, интоксикацией, болевым синдромом.
Дата добавления: 2015-02-10; просмотров: 1935;
