Состояние обратимого процесса, при котором скорости прямой и обратной реакции равны, называется химическим равновесием.
Концентрацииреагирующих веществ, которыеустанавливаются прихимическом равновесии, называются равновесными концентрациями.Обычно их обозначают при помощи квадратных скобок: [H2],[I2], [HI], в отличие от неравновесных концентраций, обозначаемых Сн2. СI2 Chi.
При установившемся равновесии
v1=v2,
где v1 - скорость прямой реакции, v2 - скорость обратной реакции.
Следовательно, для обратимого процесса
aA+bB↔cC+dD
vl=v2 = k1[A]a[B]b=k2[C]c[D]d.
Откуда
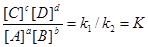 ,
,
где К - константа химического равновесия. Она не зависит от начальной
концентрации реагирующих веществ и изменяется при изменении температуры.
Чем больше К, тем больше концентрация конечных продуктов в момент
равновесия. Она показывает, во сколько раз прямая реакция идет быстрее
обратной при одинаковой температуре и концентрациях, равных единице. Это и
есть выражение закона действующих масс для обратимых реакций. Его
формулировка такова: при обратимых реакциях равновесие наступает
тогда, когда произведение концентраций образующихся веществ, деленное
на произведение концентраций веществ, вступающих в реакцию,
становится равным некоторой постоянной для данной реакции величине
при данной температуре.
Зная равновесные концентрации, легко вычислить константу равновесия и исходные концентрации реагирующих веществ.
Пример: равновесие реакции, протекающей по уравнению
Н2+I2↔2HI
установилось при следующих концентрациях участвующих в ней веществ: [Н2]=0,004 моль/л, [I2]=0,025 моль/л, [НI]=0,08 моль/л. Определить константу равновесия и исходные концентрации водорода и йода.
Решение: находим значение константы равновесия для реакции по уравнению
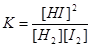
Подставив значения концентраций веществ при равновесии, находим -К=0,082/(0,004*0,025)=64.
Уравнение реакции показывает, что из одной молекулы Н2 и одной молекулы I2 образуется две молекулы HI. Следовательно, для образования 0,08 моль HI требуется 0,04 моль Н2 и 0,04 моль I2. Таким образом, исходные концентрации реагирующих веществ равны
[Н2]=0,004+0,04=0,044 моль/л,
[I2]=0,025+0,04=0,065 моль/л.
Твердые веществ не входят в выражение константы равновесия по той же причине, что и при рассмотрении скорости реакции. Например, для реакции
3Fe(тв)+4H2O(ж)↔Fe3O4(тв)+4Н2 (г),
выражение для константы равновесия выглядит следующим образом
К=[Н2]4/[Н2О]4.
ТЕМА 4.4 СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
Изменяя условия (концентрацию, температуру, давление), можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям.
Химическое равновесие смещается, потому что изменение условий не одинаково влияет на скорости прямой и обратной реакции. Через некоторое время эти скорости вновь сравниваются, и наступает состояние равновесия, отвечающее новым условиям. Изменение равновесных концентраций реагирующих веществ, вызванное изменением какого-либо условия, называется смещением равновесия.
Если при изменении условий увеличилась концентрация образующихся веществ, т.е. веществ, формулы которых находятся в правой части уравнения, то говорят о смещении равновесия вправо. Если изменение влечет увеличение концентраций исходных веществ, формулы которых стоят в левой части уравнения, то это рассматривают как смещение влево.
Смещение химического равновесия с измерением условий подчиняется правилу, которое называется принципом Ле Шателье: изменение одного из условий, при котором система находится в состоянии химического равновесия, вызывает смещение равновесия в направлении той реакции, которая противодействует произведенному изменению.
Нарастание противодействия, т.е. образование продуктов реакции, накапливающихся вследствие вызванного смещения равновесия, продолжается до того момента, пока система не достигнет нового равновесия, соответствующего новым условиям.
Дата добавления: 2015-02-10; просмотров: 1488;
