Двойной электрический слой. Электродный потенциал
При погружении металлической пластины в раствор соли данного металла (электрод или полуэлемент) может происходить один из двух процессов:
1. Если металл является активным восстановителем (т. е. легко теряет электроны), то под действием диполей воды, содержащихся в растворе, некоторая часть атомов металла оставляет свои электроны на электроде и в виде гидратированных ионов переходит в раствор:
Me0 + mH2О → Men+ • mН2О + п  .
.
в растворе на электроде
Или без учета гидратации ионов:
Ме0 → Меn+ + п  .
.
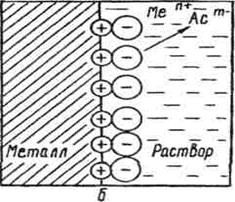
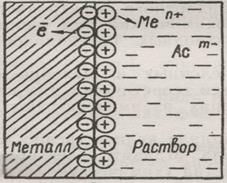
В результате этого процесса окисления металлическая пластинка заряжается отрицательно, а катионы металла притягиваются к ней и поэтому прилегающий к пластинке слой раствора заряжается положительно. Таким образом на границе металл—раствор возникает двойной электрический слой (ДЭС), как это показано на рис. 1.
|
а
Рис. 1. Образование двойного электрического слоя на границе
Металл – раствор его соли MemAcn:
a – в результате перехода ионов металла в раствор;
б – в результате перехода ионов металла из раствора
2. Если сам металл является слабым восстановителем, то его ионы, содержащиеся в растворе соли, являются сильными окислителями. Некоторая часть этих ионов подходит к поверхности металлической пластины и восстанавливается за счет имеющихся в ней свободных электронов:
 Men+ + п
Men+ + п  → Ме0.
→ Ме0.
В результате осаждения катионов пластина металла заряжается положительно и притягивает к себе отрицательно заряженные анионы. Поэтому прилегающий к пластине слой раствора заряжается отрицательно, как это показано на рис. 1 б. Таким образом, и в этом случае возникает ДЭС.
Разность потенциалов, возникающая в ДЭС на границе металл-раствор, называется электродным потенциалом.
Непосредственно измерить потенциал отдельного электрода (металла) невозможно. Поэтому электродные потенциалы измеряют относительно стандартного водородного электрода, потенциал которого принимают равным нулю. Потенциал каждого электрода (металла) зависит от природы металла, концентрации его ионов в растворе, температуры.
Водородный электрод представляет из себя сосуд с серной кислотой (рис. 2), в который опущена платиновая пластинка, электролитически покрытая губчатой платиной, через которую пропускается водород.
|
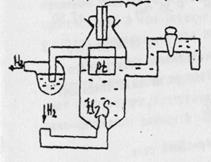
Рис. 2. Стандартный водородный электрод
Водород растворяется в платине и частично переходит в раствор в виде катионов водорода:

 2Н+ + 2
2Н+ + 2  Н2.
Н2.
Принято считать потенциал водородного электрода равным нулю при условии, что давление в сосуде 105 Па, температура 298 К, а концентрация Н+ в растворе серной кислоты – 1 г-ион/л. Такой электрод называется стандартным.
Разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом при стандартных условиях называется стандартным электродным потенциалом металла (Е0).
Металлы, расположенные в порядке возрастания алгебраического значения их стандартного электродного потенциала, составляют электрохимический ряд напряжений (ряд стандартных электродных потенциалов), представленный в таблице.
Электродные потенциалы щелочных и щелочно-земельных металлов рассчитываются теоретически, так как эти металлы в водных растворах взаимодействуют с водой.
Значение электродного потенциала количественно характеризует способность металла отдавать электроны, т. е. его восстановительные свойства (химическую активность металла). В этом ряду восстановительная активность металлов в водных растворах сверху вниз уменьшается: металлы, стоящие в начале ряда, легко отдают электроны и превращаются в положительно заряженные ионы; металлы, стоящие в конце ряда, с трудом отдают электроны. И наоборот, окислительная способность катионов металлов сверху вниз увеличивается.
Металлический литий Li – самый сильный восстановитель, а золото Аu – самый слабый. Ион золота Au3+– самый сильный окислитель, ион лития Li+– самый слабый.
На основании ряда напряжений можно сделать некоторые важные заключения о химической активности металлов.
1. Каждый металл вытесняет из солей другие металлы, имеющие большие значения стандартных электродных потенциалов, т. е. являющиеся менее сильными восстановителями.
2. Металлы, имеющие стандартный электродный потенциал меньше нуля (т. е. потенциала стандартного водородного электрода), способны вытеснять водород из кислот.
3. Металлы, имеющие очень низкие значения стандартного электродного потенциала, т. е. являющиеся сильными восстановителями (от лития до натрия), в любых водных растворах взаимодействуют прежде всего с водой.
Электрохимический ряд напряжений металлов
| Металл | Электродная реакция | E0, В |
| Li | Li = Li+ + 
| -3,045 |
| Rb | Rb = Rb+ + 
| -2,925 |
| K | K = K+ + 
| -2,924 |
| Ba | Ba = Ba2+ + 2 
| -2,90 |
| Sr | Sr = Sr2+ + 2 
| -2,89 |
| Ca | Ca = Ca2+ + 2 
| -2,87 |
| Na | Na = Na+ + 
| -2,714 |
| Mg | Mg = Mg2+ + 2 
| -2,37 |
| Al | Al = Al3+ + 3 
| -1,66 |
| Zr | Zr = Zr+ + 
| -1,58 |
| Mn | Mn = Mn2+ + 2 
| -1,18 |
| V | V = V2+ + 2 
| -1,18 |
| Cr | Cr = Cr2+ + 2 
| -0,913 |
| Zn | Zn = Zn2+ + 2 
| -0,763 |
| Cr | Cr = Cr3+ + 3 
| -0,74 |
| Fe | Fe = Fe2+ + 2 
| -0,44 |
| Cd | Cd = Cd2+ + 2 
| -0,403 |
| Co | Co = Co2+ + 2 
| -0,277 |
| Ni | Ni = Ni2+ + 2 
| -0,25 |
| Sn | Sn = Sn2+ + 2 
| -0,136 |
| Pb | Pb = Pb2+ + 2 
| -0,126 |
| Fe | Fe = Fe3+ + 3 
| -0,037 |
| H | H2 = 2H+ + 2 
| 0,000 |
| Cu | Cu = Cu2+ + 2 
| +0,34 |
| Cu | Cu = Cu+ + 
| +0,52 |
| Hg | 2Hg = Hg 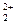 + 2 + 2 
| +0,79 |
| Ag | Ag = Ag+ + 
| +0,80 |
| Hg | Hg = Hg2+ + 2 
| +0,85 |
| Pt | Pt = Pt2+ + 2 
| +1,19 |
| Au | Au = Au3+ + 3 
| +1,50 |
| Au | Au = Au+ + 
| +1,70 |
Положение металлов в электрохимическом ряду напряжений не вполне соответствует их положению в периодической системе. Это объясняется тем, что при измерении электродных потенциалов учитывается не только энергия отрыва электронов от отдельных изолированных атомов, но и энергия, которая тратится на разрушение кристаллической решетки и которая выделяется при гидратации ионов.
Зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах, и от температуры выражается уравнением Нернста:
Е = Е0 + 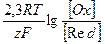
Здесь Е0 – стандартный электродный потенциал; R – газовая постоянная; Т – абсолютная температура; F – постоянная Фарадея (96 500 Кл/моль); z – число электронов, участвующих в электродном процессе; [Ох] и [Red] –произведения концентраций (активностей) веществ, принимающих участие в соответствующей полуреакиии в окисленной (Ох) и восстановленной (Red) формах.
Уравнение Нернста после подстановки в него значений R, F и Т приобретает для 250С (298 К) следующий вид:
Е = Е0 + 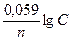 ,
,
где n – число электронов, принимающих участие в процессе; С – концентрация ионов металла в растворе, моль/л.
Когда в электродном процессе участвует вода, электродный потенциал зависит от концентрации ионов Н+ (или ОН-), т. е. от рН раствора.
Из уравнения Нернста:
Е = Е0 + 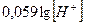 ,
,
рН = 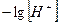 ,
,
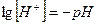 ,
,
Е = – 0,059 рН.
В нейтральных растворах (рН = 7)Е = -0,059·7≈ -0,41 В.
Дата добавления: 2015-01-10; просмотров: 3469;
