Общее число электронов, которые отдает восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель.
1. Составить схему реакции
KMnO4 + H3PO3 + H2SO4 = MnSO4 + H3PO4 + K2SO4 + H2O.
2. Определить, атомы каких элементов изменяют степени окисления
+7 +3 +2 +5
KMnO4 + H3PO3 + H2SO4 = MnSO4 + H3PO4 + K2SO4 + H2O.
3. Составить электронные уравнения процессов окисления и восстановления:
Р+3 – 2е = Р+5 окисление;
Mn+7 + 5e = Mn+2 восстановление.
4. В электронных уравнениях подобрать такие коэффициенты, чтобы число электронов, которые отдает восстановитель (Р+3), было равно числу электронов, которые присоединяет окислитель (Mn+7):
 восстановитель Р+3 – 2е = Р+5 5 окисление;
восстановитель Р+3 – 2е = Р+5 5 окисление;
окислитель Mn+7 + 5e = Mn+2 2 восстановление.
5Р+3 + 2 Mn+7 = 5Р+5 + 2 Mn+2.
4. Перенести эти коэффициенты в схему реакции. Затем подобрать коэффициенты перед формулами других веществ в уравнении реакции
2KMnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O.
Правильность составления уравнения определяют по числу атомов кислорода в левой и правой частях уравнения.
Встречаются реакции, в которых число частиц, изменяющих свою степень окисления, больше двух. Тогда определяют общее число электронов, отданных восстановителями, и общее число электронов, принятых окислителями, и далее находят коэффициенты обычным способом. Например:
+2 -1 +7 +3 0 +2
FeCl2 + KMnO4 + HCl → FeCl3 + Cl2 + MnCl2 + KCl + H2O;
 Fe+2 – 1e = Fe+3
Fe+2 – 1e = Fe+3
5 │ 3  процессы окисления;
процессы окисления;
2Cl- - 2e = Cl 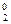
3 │ Mn+7 + 5e = Mn+2 процесс восстановления;
Fe+2 , Cl-1 – восстановители; Mn+7 – окислитель;
5FeCl2 + 3KMnO4 + 24HCl = 5FeCl3 + 5Cl2 + 3MnCl2 + 3KCl + 12H2O.
Электродные потенциалы.
Гальванические элементы
Дата добавления: 2015-01-10; просмотров: 1678;
