Химическая кинетика
Химическая кинетика –это раздел химии, изучающий скорость протекания химических реакций и факторы, влияющие на нее. Химические реакции бывают гомогенными и гетерогенными. Если реагирующие вещества находятся в одной фазе – это гомогенная реакция, а если в разных – гетерогенная.
Фаза– это часть системы, отделенная от других частей поверхностью раздела, при переходе через которую свойства системы изменяются скачкообразно.
Примером гомогенной реакции служит взаимодействие растворов AqNO3 и NaCl. Эта реакция протекает быстро и по всему объему:
AqNO3 + NaCl = AqCl + NaNO3.
 Примером гетерогенной реакции является процесс растворения цинка в растворе серной кислоты:
Примером гетерогенной реакции является процесс растворения цинка в растворе серной кислоты:
Zn + H2SO4 = ZnSO4 + H2
Скоростью гомогенной реакцииназывается изменение концентрации вещества, вступающего в реакцию или образующегося в ходе реакции ∆С в единицу времени ∆t 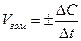 ,
,
(+) – ставится в том случае, если следят за изменением концентрации продуктов реакции, которая в ходе реакции увеличивается;
(-) – когда следят за изменением концентрации исходных веществ, которая в ходе реакции уменьшается.
Скоростью гетерогенной реакцииназывается изменение количества вещества, вступающего в реакцию или образующегося в ходе реакции ∆n в единицу времени ∆t на единице площади ∆S:
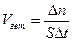 .
.
Дата добавления: 2015-01-10; просмотров: 889;
