Определения и терминология
Химия кислот и основанийКонцентрация ионов водорода и рН
В любом водном растворе молекулы воды обратимо диссоциируют на ионы водорода и гидроксид-ные ионы:
H2O ~ H+ + ОН'.
Кинетику этого процесса можно описать с помощью константы диссоциации Kw:
Kw= [H+] х [OhT] = I (Г14.
Концентрацию воды в знаменателе этого уравнения опускают, поскольку она не имеет существенного значения и уже включена в константу. Следовательно, если [H+] или [ОН~] известна, можно легко рассчитать концентрацию другого иона.
Пример:если [H+] = КГ8 нмоль/л, тогда [ОН ] = KT1VlO'8= 10~6 нмоль/л.
В норме [H+] артериальной крови составляет 40 нмоль/л (40 X КГ9 моль/л). Проводить расчеты с числами такого порядка крайне неудобно, поэтому концентрацию ионов водорода принято выражать через рН. рН раствора — это отрицательный десятичный логарифм концентрации ионов водорода (рис. 30-1). Следовательно, в норме рН артериальной крови составляет -log (40 X 10~9) = 7,40. Концентрация ионов водорода от 16 до 160 нмоль/л (рН 6,8-7,8) совместима с жизнью.
Как и большинство других констант диссоциации, Kw зависит от температуры. Если температура составляет 25 0C, то точка электронейтральности для воды достигается при рН 7,0, если 37 0C — то при рН 6,8. Изменения рН в зависимости от температуры имеют важное значение при гипотермии (гл.21).
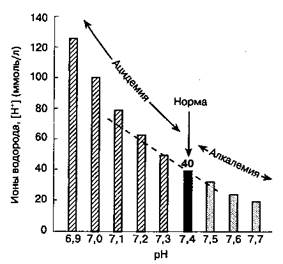
Рис. 30-1.Взаимосвязь между рР1 и [H+]. В интервале значений рН от 7,1 до 7,5 зависимость между рН и [H+] принимает почти линейный характер. (Из: Narins R. G., Emmett M. Simple and Mixed Acid-base Disorders: A Practical Approach. Medicine, 1980; 59: 161.)
Дата добавления: 2015-02-03; просмотров: 889;
