Химическая кинетика И катализ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ 3 страница
Хотя с.о., как отмечалось выше, довольно формальное понятие, оно применяется в химии для следующих целей: во-первых, для составления уравнений ОВР, во-вторых, для предсказания окислительно-восстановительных свойств элементов в соединении.
Таблица 13.1
Степени окисления различных элементов
| Элемент | Значения степени окисления и примеры соединений |
| F | –1 (HF, KF) |
| O | –2 (H2O, CaO, CO2); –1 (H2O2); +2 (OF2) |
| N | –3 (NH3); –2(N2H4); –1 (NH2OH); +1 (N2O); +2 (NO); +3 (N2O3, HNO2); +4 (NO2); +5 (N2O5, HNO3) |
| Cl | –1 (HCl, NaCl); +1 (NaClO); +3 (NaClO2); +5 (NaClO3); +7 (Cl2O7, NaClO4) |
| Br | –1 (KBr); +1 (BrF); +3 (BrF3); +5 (KBrO3) |
| I | –1 (HI); +1 (ICl); +3 (ICl3); +5 (I2O5); +7 (IO3F, K5IO6) |
| C | –4 (CH4); +2 (CO); +4 (CO2, CCl4) |
| Si | –4 (Ca2Si); +2 (SiO); +4 (SiO2, H2SiO3, SiF4) |
| H | –1 (LiH); +1 (H2O, HCl) |
| S | –2 (H2S, FeS); +2 (Na2S2O3); +3 (Na2S2O4); +4 (SO2, Na2SO3, SF4); +6 (SO3, H2SO4, SF6) |
| Se, Te | –2 (H2Se, H2Te); +2 (SeCl2, TeCl2); +4 (SeO2, TeO2); +6 (H2SeO4, H2TeO4) |
| P | –3 (PH3); +1 (H3PO2); +3 (H3PO3); +5 (P2O5, H3PO4) |
| As, Sb | –3 (GaAs, Zn3Sb2); +3 (AsCl3, Sb2O3); +5 (H3AsO4, SbCl5) |
| Li, Na, K | +1 (NaCl) |
| Be, Mg, Ca | +2 (MgO, CaCO3) |
| Al | +3 (Al2O3, AlCl3) |
| Cr | +2 (CrCl2); +3 (Cr2O3, Cr2(SO4)3); +4 (CrO2); +6 (K2CrO4, K2Cr2O7) |
| Mn | +2 (MnSO4); +3 (Mn2(SO4)3); +4 (MnO2); +6 (K2MnO4); +7 (KMnO4) |
| Fe | +2 (FeO, FeSO4); +3 (Fe2O3, FeCl3); +4 (Na2FeO3) |
| Cu | +1 (Cu2O); +2 (CuO, CuSO4, Cu2(OH)2CO3) |
| Ag | +1 (AgNO3) |
| Au | +1 (AuCl); +3 (AuCl3, KAuCl4) |
| Zn | +2 (ZnO, ZnSO4) |
| Hg | +1 (Hg2Cl2); +2 (HgO, HgCl2) |
| Sn | +2 (SnO); +4 (SnO2, SnCl4) |
| Pb | +2 (PbO, PbSO4); +4 (PbO2) |
Для многих элементов характерно несколько значений с.о. (табл. 13.1), и, вычислив его с.о., можно предвидеть окислительно-восстановительные свойства: элемент в наибольшей отрицательной степени окисления может только отдавать электроны (окисляться) и быть восстановителем, в наибольшей положительной с.о. – только принимать электроны (восстанавливаться) и быть окислителем, в промежуточных степенях окисления – и окисляться, и восстанавливаться. Кроме того, и другие свойства соединений элемента в одной и той же с.о. оказываются похожими. Теперь рассмотрим, как степени окисления используются при составлении ОВР.
§ 2. Составление уравнений окислительно-восстановительных реакций (ОВР).Исходя из основных определений реакции с переносом электрона для составления материального баланса ОВР применяют так называемый метод полуреакций: разделение стадий окисления и восстановления на отдельные. При этом следует четко принимать, что эти две стадии одновременны и суть одного процесса («две стороны одной медали»).
В каждой из них учитывается материальный и зарядный балансы, затем они стехиометрически складываются с учетом равенства числа электронов «отдающихся» и «принимающихся» в полуреакциях. Проиллюстрируем это на следующем примере (в «Практикуме» этот материал разобран более детально).
Рассмотрим реакцию K2Cr2O7 с KI. По методу полуреакций поступают следующим образом.
Исключаем из уравнения реакции все ионы-наблюдатели, т.е. ионы, реально не принимающие участия в реакции (в нашем случае K+ и SO42–):
Cr2O72– + I– + H+ ® Cr3+ + I2 + H2O.
Составляем уравнения полуреакций, одна из которых включает Cr, а другая I:
Cr2O72– ® 2Cr3+
2I– ® I2
Сбалансируем число атомов в уравнении каждой полуреакции, добавив к ним H+ и H2O, если реакция протекает в кислой среде, либо H2O и OH–, если реакция протекает в щелочной среде:
Cr2O72– + 14H+ ® 2Cr3+ + 7H2O (атомы Cr, O и H сбалансированы),
2I– ® I2.
Сбалансируем заряды, добавляя необходимое число электронов:
Cr2O72– + 14H+ + 6 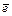 ® 2Cr3+ + 7H2O,
® 2Cr3+ + 7H2O,
2I– ® I2 + 2 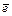 .
.
Обратите внимание, что входящее в сбалансированные уравнения полуреакций число электронов точно соответствует изменению с.о. (два атома Cr принимают 6 электронов, два атома I отдают 2 электрона).
Умножаем уравнения полуреакций на такие коэффициенты, чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых окислителем (в нашем случае второе уравнение надо умножить на три):
Cr2O72– + 14H+ + 6 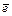 ® 2Cr3+ + 7H2O,
® 2Cr3+ + 7H2O,
6I–® 3I2 + 6 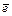 .
.
Складываем уравнения двух полуреакций и исключаем одинаковые частицы, содержащиеся в правой и левой части. Убеждаемся, что уравнение соответствует законам сохранения массы и заряда:
Cr2O72– + 6I– + 14H+ = 2Cr3+ + 3I2 + 7H2O.
Добавляем в уравнение ионы-наблюдатели:
K2Cr2O7 + 6KI + 7H2SO4 = 4K2SO4 + Cr2(SO4)3 + 3I2 + 7H2O.
Таким образом, кратко последовательность действий можно передать так: полуреакции–полная реакция–ионы–наблюдатели. Метод полуреакций наиболее удобен для составления уравнений реакций в водных растворах, особенно когда неизвестны все продукты реакции, однако для составления уравнений реакций с участием твердых веществ он неудобен, т.к. в этом случае часто приходится формально вводить в полуреакции не существующие на самом деле частицы, например, ионы O2–. При составлении уравнений электролиза также используется метод полуреакций, т.к. в этом случае полуреакции действительно происходят порознь, на разных электродах.
Видно, что ОВР в растворах – сложные; включают в себя реакции кислотно-основного равновесия (нейтрализация, гидролиз).
Среди ОВР выделяются реакции диспропорционирования, отличающиеся тем, что один и тот же элемент в одной и той же степени окисления является и окислителем, и восстановителем (поэтому в старых учебниках они назывались также реакциями самоокисления-самовосстановления):
2Pb2+ ⇄ Pb4++Pb0 2Cu+ ⇄ Cu2++Cu0.
Рассмотрим реакцию взаимодействия магния с разбавленной азотной кислотой, в результате которой получаются нитраты магния и аммония:
Mg + HNO3 ® Mg(NO3)2 + NH4NO3
Удалим из уравнения реакции ионы-наблюдатели
Mg + NO3– ® Mg2+ + NH4+.
Запишем уравнения полуреакций:
Mg ® Mg2+,
NO3– ® NH4+.
Сбалансируем атомы (обратите внимание, что среди продуктов второй
полуреакции добавляются три молекулы воды):
Mg ® Mg2+,
NO3– + 10H+ ® NH4+ + 3H2O.
Сбалансируем заряды:
Mg = Mg2+ + 2 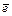 ,
,
NO3– + 10H+ + 8 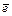 = NH4+ + 3H2O.
= NH4+ + 3H2O.
Сложим полуреакции:
4Mg + NO3– + 10H+ = 4Mg2+ + NH4+ + 3H2O.
Добавим ионы-наблюдатели:
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O.
Для многих ОВР состав продуктов зависит от условий протекания реакции. Так, при взаимодействии азотной кислоты с металлами в зависимости от природы металла и концентрации HNO3 последняя может восстанавливаться до аммиака (нитрата аммония), молекулярного азота, оксидов азота (II) или (IV), а на практике всегда получается смесь продуктов восстановления:
Ag + HNO3(конц.) = AgNO3 + NO2 + H2O
3Ag + 4HNO3(разб.) = 3AgNO3 + NO + 2H2O
Одним из наиболее широко используемых в лабораторной практике окислителей является перманганат калия KMnO4 (список распространенных окислителей и восстановителей приведен в табл. 13.2). В зависимости от условий проведения реакция восстановления протекает по-разному:
MnO4– + 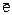 = MnO42– (в щелочной среде),
= MnO42– (в щелочной среде),
MnO4– + 2H2O + 3 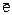 = MnO2¯ + 4OH– (в нейтральной среде),
= MnO2¯ + 4OH– (в нейтральной среде),
MnO4– + 8H+ + 5 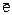 = Mn2+ + 4H2O (в кислой среде).
= Mn2+ + 4H2O (в кислой среде).
Таблица 13.2
Распространенные окислители и восстановители
| Окислители | Восстановители |
| Свободные галогены Кислород O2, озон O3, пероксид водорода H2O2 Азотная кислота HNO3, оксид азота (IV) NO2 Конц. серная кислота H2SO4 Селеновая кислота H2SeO4 Перманганат калия KMnO4, манганат калия K2MnO4, Оксид марганца (IV) MnO2 Бихромат калия K2Cr2O7, хромат калия K2CrO4 Оксид меди (II) CuO, оксид серебра (I) Ag2O Оксид свинца (IV) PbO2 Ионы благородных металлов (Ag+, Au3+) Хлорид железа (III) FeCl3 Гипохлориты, хлораты и перхлораты Царская водка (смесь HNO3+3HCl) Анод при электролизе | Свободные металлы Водород и гидриды металлов Уголь, оксид углерода (II) CO Сероводород H2S, оксид серы (IV) SO2 Сернистая кислота H2SO3 и ее соли Иодоводородная кислота HI и ее соли, бромоводородная кислота HBr, соляная кислота HCl Хлорид олова (II) SnCl2, сульфат железа FeSO4, сульфат марганца MnSO4 Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота (II) NO Фосфористая кислота H3PO3 Альдегиды, спирты, муравьиная и щавелевая к-ты Глюкоза Катод при электролизе |
§ 3. Окислительно-восстановительные эквиваленты.При рассмотрении взаимодействия кислот и оснований удобно использовать понятия кислотно-основного эквивалента и эквивалентной массы кислоты (основания). Эквивалентная масса кислоты равна молярной массе, деленной на основность кислоты. Для одноосновных кислот эквивалентная масса совпадает с молярной массой, например MЭ(HCl) = M(HCl) = 36,5 г/моль; для двухосновных кислот эквивалентная масса равна половине молярной массы (MЭ(H2SO4) = M(H2SO4)/2 =
(98 г/моль)/2 = 49 г/моль) и т.д. Таким образом, эквивалентная масса кислоты – это количество кислоты, которое способно отщепить 1 моль протонов. Аналогично, эквивалентная масса основания – это количество основания, которое способно нейтрализовать 1 моль протонов (или отщепить 1 моль гидроксид-ионов), например, MЭ(NaOH) = M(NaOH) = 40 г/моль; MЭ(Ca(OH)2) = M(Ca(OH)2)/2 =
(74 г/моль)/2 = 37 г/моль.
Теперь аналогичным образом введем определение окислительно-восстановительного эквивалента.
Эквивалентом окислителя (восстановителя) называется такое количество вещества, которое в ходе ОВР принимает (отдает) 1 моль электронов.
Эквивалентную массу окислителя (восстановителя) легко найти, разделив молярную массу на число принимаемых (отдаваемых) в реакции электронов. Например сернистая кислота, отдавая два электрона, окисляется в серную, тогда эквивалентна масса равна
MЭ(H2SO3) = M(H2SO3)/2 = (82 г/моль)/2 = 41 г/моль.
Обратите внимание, что для многих веществ эквивалентная масса – величина переменная, зависящая от того, что какой реакцией она определяется. Так, перманганат калия в различных условиях (см. выше) может принимать один, три или пять электронов, и эквивалентная масса для этих случаев будет составлять соответственно M(KMnO4), M(KMnO4)/3, M(KMnO4)/5 (158 г/моль, 52,7 г/моль, 31,6 г/моль). Когда на склянке с 0,02 М раствором KMnO4 пишут 0,1 н. р-р KMnO4, то при этои подразумевают, что все реакции с его участием будут происходить в кислой среде, MnO4–восстановится до Mn2+. Если применять этот раствор в других условиях, то использование его нормальности в расчетах приведет к ошибке.
Раствор KMnO4 точно известной концентрации используют для определения концентрации восстановителей. Этот метод анализа называется перманганатометрией.
Ещё одна важная для химического анализа реакция – взаимодействие иода с тиосульфатом натрия, происходящее согласно уравнению:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Эта реакция может использоваться для определения содержания иода, но чаще иодометрия используется для определения концентрации окислителей.
§ 4. Потенциал восстановления (окисления). Разность потенциалов.Учитывая, что окислительно-восстановительные реакции протекают с переносом электрона – заряда, то каждая стадия (полуреакция) обладает электростатическим потенциалом (Е, j), выражаемых в вольтах (В). В природе потенциалы окисления, восстановления меняются практически от –3 до +3 В. Чтобы не путаться в знаках потенциала, принято писать их в форме потенциалов восстановления, т.е. +. Все они табулированы (см. «Практикум») в такой форме. Для ОВР соответственно вводится разность потенциалов (DЕ,Dj) – ЭДС, В. Разность потенциалов ОВ системы, с точки зрения термодинамики, связана с DG соотношением: DG = –Amax = nFDE, где Amax – работа, совершаемая системой, n – число электронов, F – число Фарадея 96484,56 Кл/моль. Таким образом, разность потенциалов (DE) является термодинамической характеристикой ОВР, и следуя выше приведенному уравнению реакция будет протекать самопроизвольно (слева направо), когда DE > 0 – положительна. Таким образом, разность потенциалов характеризует направленность ОВР. В «Практикуме» приведены примеры и лабораторные работы, иллюстрирующие это положение. На практике способность ОВ систем за счет разности потенциалов производить полезную работу реализуется в гальванических элементах (Вольта, Якоби-Даниэля), батарейках и др.
Количественно равновесный (реальный) потенциал связан с природой и концентрацией ОВ пары по формуле Нернста:
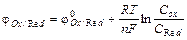 , (13.1)
, (13.1)
где jOx/Red – равновесный потенциал; 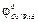 – стандартный ОВ потенциал (он табулирован и определяется только природой веществ); R – универсальная газовая постоянная; Т – температура, К; n – число электронов; COx/Red – концентрации окислителя (восстановителя), моль/л.
– стандартный ОВ потенциал (он табулирован и определяется только природой веществ); R – универсальная газовая постоянная; Т – температура, К; n – число электронов; COx/Red – концентрации окислителя (восстановителя), моль/л.
При подстановке в формулу Нернста значений R, Т = 298 К для стандартных условий и коэффициента перевода натурального логарифма в десятичный (2,303) и она будет:
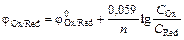 . (13.2)
. (13.2)
ОВР протекают как в свободном объеме, так и на электродах, что мы рассмотрим в следующих лекциях.
§ 5. Диаграмма электрохимической устойчивости воды. Химическая стойкость металлов в водных растворах. Металл, растворяющийся в воде, растворе кислоты или основания, является восстановителем (Red), он окисляется. Это растворение может быть целенаправленным (химическое фрезерование) и нежелательным (коррозия). Необходимым условием протекания окислительно-восстановительного (Ox-Red) процесса является наличие окислителя (Ox). С учетом протекания ОВР в воде, то необходимо рассмотреть роль воды в них. Напомним, что в воде имеются Н+, OH–и растворенный О2.
В кислотной среде (0£рН<7) в качестве окислителя могут выступать ионы водорода Н+ или «сложный» окислитель Н++О2; в нейтральной (рН=7) и в щелочной среде (7<рН£14) окислителем являются молекулы H2O или смесь воды и кислорода (H2O+O2), а также OH–.
Металл, контактирующий одновременно с газом и раствором, содержащим ионы этого газа, называется газовым электродом (водородным, кислородным и др.). Потенциалы водородного и кислородного электродов не зависят от формы разряжающихся частиц (молекул воды или ионов, на которые она диссоциирует), но зависят от рН среды и парциального давления водорода (PH2) и кислорода (PO2):
2Н++2 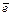 =Н2 2H2O+2
=Н2 2H2O+2 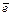 =2ОН–+Н2
=2ОН–+Н2
4Н++О2+4 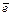 =2H2O 2H2O+О2+4
=2H2O 2H2O+О2+4 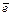 =4ОН–
=4ОН–
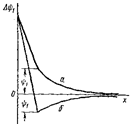
Зависимость jН+/Н2и jО2/ОН–от рН при PH2= PO2= 1ат представлена уравнениями и графически – в виде диаграммы электрохимической устойчивости воды (рис. 13.1).
jН+/Н2=–0,059 рН, jО2/ОН– = 1,23–0,059 рН
По диаграмме (рис. 13.1) можно установить химическую стойкость металлов в растворах с различным значением рН. Отметим, что известный ряд напряжений jMen+/Me, B:
| Li+/Li | K+/K | Na/Na | Mg2+/Mg | Al3+/Al | Zn2+/Zn | Fe2+/Fe | ||||||
| –3,02 | –2,92 | –2,71 | –2,38 | –1,66 | –0,76 | –0,44 | ||||||
| Pb2+/Pb | 2H+/H2 | Cu2+/Cu | Ag+/Ag | Pt2+/Pt | Au+/Au | |||||||
| –0,13 | 0,00 | +0,34 | +0,79 | +1,20 | +1,70 | |||||||
изначально был известен как ряд способности замещения металлов друг другом в водных растворах («вытеснительный» ряд Бекетова). Когда же были установлены потенциалы Red/Ox пар металлов и катионов, он с точностью совпал с рядом Бекетова и получил количественную характеристику. С учетом электрохимической диаграммы воды он справедлив только при рН=0 (не учитывает влияние кислорода).
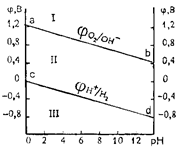 Рис. 13.1. Диаграмма электрохимической устойчивости воды.
Рис. 13.1. Диаграмма электрохимической устойчивости воды.
| Если стандартный потенциал металла (jМеn+/Me) положительнее jО2/ОН– (область 1, выше линии ab), то растворение металла с процессами восстановления по уравнениям невозможно. Все точки в области 1 соответствуют состоянию когда молекулы воды (или ионы гидроксила) могут выступать лишь как восстановители. Такое состояние имеет место на аноде при электролизе водных растворов или при взаимодействии воды или основания с сильным окислителем: |
2Cl2+2H2O=4HCl+O2, 2Cl2+4NaOH=4NaCl+2H2O+O2.
В этих реакциях молекулы воды и ионы гидроксила выступают как восстановители. Если jМеn+/Me положительнее jН+/Н2и отрицательнее jО2/ОН–(все точки между линиями ab и cd, область II), то растворение металла возможно, когда окислителем является (H++O2) или (H2O+O2), а не ионы водорода или молекулы воды. Все точки в области II соответствуют электрохимической устойчивости воды. В этой области в химических реакциях и при электролизе вода не может выступать ни окислителем, ни восстановителем.
Все точки ниже линии cd (область III) отвечают состоянию системы, когда молекулы H2O или Н+ в реакциях с металлами выступают как окислители. Этот случай условно называется «коррозией с водородной деполяризацией», которая происходит при взаимодействии H2O или иона Н+ с активными металлами. В области III при наличии в растворе газообразного кислорода в качестве окислителя в реакции с металлами могут также выступать сложные окислители (H2O + O2) или (H+ + O2). Этот случай условно называется «коррозией с кислородной деполяризацией». Таким образом, в области III могут выступать четыре окислителя, т.е. имеется возможность протекания четырех реакций восстановления.
В общем случае, при наличии в растворе нескольких видов ионов или недиссоциированных молекул электрохимически активных веществ последовательность протекания реакций восстановления определяется величиной их стандартного потенциала. В первую очередь, окислителем выступают те ионы, молекулы или их сочетания, которые характеризуются наиболее положительным потенциалом. Это, в частности, имеет место при растворении металлов в кислородсодержащих кислотах (HNO3, H2SO4 и др.), когда в качестве окислителя могут выступать анионы кислотного остатка.
Исходя из изложенного видно, что металлы находящиеся ниже линии водородного электрода встречаются, как правило, в соединениях в катионной форме; металлы находящиеся выше линии кислородного электрода встречаются в природе в форме самородков (золото).
Учитывая сказанное, легко объяснить, почему при взаимодействии металлов с азотной кислотой не выделятся газообразный водород. Примеры приведены в «Практикуме».
Лекция 14
Электрохимические процессы и системы
Процессы взаимного превращения химической и электрической форм энергии, протекающие на электродах (Ox/Red) реакции называются электрохимическими, их можно рассматривать как:
1. Самопроизвольные процессы, при которых химическая энергия превращается в электрическую. Сюда относятся химические источники тока (гальванические элементы), а также коррозионные процессы.
2. Электролиз – несамопроизвольный процесс, происходящий под действием внешнего источника постоянного электрического тока, при котором на электродах образуются новые вещества.
Особенности электрохимических процессов в том, что все они происходят на границе раздела двух фаз – твердая–жидкая – это электрод-электролит и являются Ox/Red реакциями. Ox/Red процессы определяются электродным потенциалом Ox/Red пары на электроде, напомним что на аноде идет процесс окисления, на катоде наоборот – восстановление, ЭДС процесса определяется как разность между 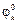 и
и 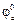 и его величина зависит от местоположения металлов в ряду электрохимической активности (напряжений).
и его величина зависит от местоположения металлов в ряду электрохимической активности (напряжений).
§ 1. Электродный потенциал металла. Двойной электрический слой. Электродом (первого рода) называют любой металл (или токопроводящий материал), погруженный в раствор электролита. Между ними существует подвижное равновесие, которое можно выразить уравнением Me ⇄ Men++n 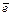 .
.
При погружении же металла в раствор начинается сложное взаимодействие металла с компонентами раствора электролита. Если энергия кристаллической решетки металла (Екрист) меньше энергии гидратации (Егидр) – Екрист < Егидр, то образующиеся ионы металла гидратируются и переходят в раствор, на поверхности металла устанавливается равновесие: Me+mH2O ⇄ Men+·mH2O+n 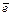 . При этом скорости прямого и обратного переходов ионов будут равны. Процесс перехода атомов металла электрода в раствор связан с потерей электронов и образованием положительно заряженных ионов, т.е. происходит окисление (Me – n
. При этом скорости прямого и обратного переходов ионов будут равны. Процесс перехода атомов металла электрода в раствор связан с потерей электронов и образованием положительно заряженных ионов, т.е. происходит окисление (Me – n 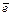 ®Men+), обратный процесс – восстановление Men++n
®Men+), обратный процесс – восстановление Men++n 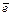 ®Me0.
®Me0.
При равенстве скоростей прямого и обратного процессов uок = uвосст электрод находится в равновесном состоянии. Положение равновесия зависит как от энергии ионизации атома металла, так и от концентрации его ионов в растворе. Гидратированные ионы металла, находящиеся у его поверхности и оставшиеся на металле избыточные электроны образуют две противоположно заряженные плоскости, аналогичные обкладке плоского конденсатора – возникает двойной электрический слой (рис. 14.1). Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода.
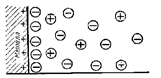 Рис. 14.1. Схема двойного электрического слоя на границе раздела металл/раствор.
Рис. 14.1. Схема двойного электрического слоя на границе раздела металл/раствор.
| 
|
Часть двойного электрического слоя, которая образуется непосредственно прилегающими к электроду ионами, называется плотной частью двойного слоя (слой Гельмгольца). Толщина плотного слоя равна радиусу гидратированных ионов. В этой части имеет место линейное изменение потенциала между электродом и плоскостью, проходящей через центры прилегающих к нему ионов. Часть двойного электрического слоя, расположенная за плотной частью, называется диффузной (слой Гуи-Чапмена). Изменение потенциала в ней нелинейно. Полный скачок потенциала на границе электрода с электролитом слагается из суммы скачков потенциалов в плотной и диффузной частях двойного электрического слоя. В 1924 г. Штерн предложил адсорбционную теорию двойного электрического слоя. Он полагал, что определенная часть ионов удерживается вблизи поверхности раздела металл-электролит, образуя плотную гельмгольцевскую обкладку двойного слоя, с толщиной, отвечающей среднему радиусу ионов электролита, остальные ионы распределяются диффузно с постепенно убывающей плотностью заряда. Дальнейшее развитие теории строения двойного электрического слоя было дано в работах Фрумкина и его школы. По их мнению, в плотной части двойного слоя следует различать внутренний и внешний гельмгольцевские слои. Внутренний слой образован специфически адсорбированными ионами, частично или полностью дегидратированными и образующими диполи с металлом, во внешнем плотном слое находятся гидратированные ионы, притянутые к поверхности металла электростатическими слоями. Непосредственно за внешним гельмгольцевским следует диффузный слой.
Дата добавления: 2015-01-26; просмотров: 752;
