Основные положения теории электролитической диссоциации С.Аррениуса.
1. Электролитам в водной среде (и в расплавленном состоянии) свойственно распадаться на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированны (аквакомплексы). Так, нейтральный атом натрия +11Na 1s22s22p63s1 при обычных условиях легко отдает наружный (3s1) электрон (окисляется). Натрий бурно реагирует с водой, кислотами, химически активен.
Ион (катион) натрия +11Na+ 1s22s22p6 не может отдавать электроны (окисляться), не реагирует с водой.
2. Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду. Этим объясняется ионная проводимость водных растворов и расплавов электролитов.
NaOH 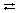 Na+ + OH–. Na+ + OH–.
| Гидpaтированныe анионы гидроксильных групп, двигаясь к аноду, окрашивают нейтральный (фиолетового цвета) лакмус в синий цвет. |
HCl 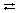 H+ + Cl–. H+ + Cl–.
| Катионы гидроксония H3O+, двигаясь к катоду, окрашивают лакмус в красный цвет. |
3. Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:
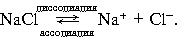
3. Составьте уравнения гидролиза Be(NO3)2, Rb2S, BaCl2 в молекулярном и ионном виде. Укажите рН среды.
Дата добавления: 2015-01-21; просмотров: 1722;
