Протекторная и катодная защита металлов от коррозии.
Коррозия является электрохимическим процессом, образующим электрические потенциалы на участках поверхности металла с появлением при этом электрического тока (называемого в данном случае коррозионным током). Поэтому основным принципом активной катодной защиты черных металлов является защита посредством «жертвенных» электронов. Принцип заключается в том, что один металл (в данном случае – цинк) расходуется (жертвуется) для защиты другого металла (железо). Основной довод в пользу применения в качестве защитного покрытия для стали именно цинка — то, что цинк подвергается ржавлению гораздо медленнее, нежели железо.
Существует несколько способов катодной защиты металла от коррозии:
– присоединить к «плюсу» аккумуляторной батареи защищаемый металл (подземный трубопровод), сделав его катодом;
– прикрепить к днищу корабля (или нефтепроводу) цинковую пластину, которая будет ржаветь, защищая сталь (такая пластина называется протектором, а катодная защита — протекторной);
– покрыть цинком (анодом) защищаемую металлическую поверхность.
Последний метод защиты оказался самым эффективным и получил название — цинкование (оцинковка). Эффект в данном случае достигается за счёт очень хорошего электрического контакта между цинком и сталью.
Протекторная защита металла — способ антикоррозионной защиты, при котором защищаемой поверхности необходимо обеспечить контакт с более активным металлом (ссылка). По отношению к железу, более активными металлами являются кадмий, хром, цинк, магний и другие металлы.
Из механизма коррозии металла, следует, что более активный металл начинает испускать электроны и присоединять к образовавшимся ионам гидроксильной группы из раствора электролита, а другой, менее активный, будет принимать электроны, присоединяя их к своим ионам. В результате, более активный металл — анод — будет окисляться, а менее активный металл — катод восстанавливаться. Таким образом, анод будет защищать от коррозии
В результате, анод будет окисляться, а
Протекторная защита нашла широкое применение для защиты таких объектов как: подземные трубопроводы, резервуары, морские и речные суда и др. Все эти объекты находятся в постоянном контакте с электролитом, будь то грунтовые воды, химические растворы, морская или речная вода.
Для реализации протекторной защиты необходимо обеспечить соприкосновение самого протектора с чистой поверхностью защищаемого металла См. Рис. 1.
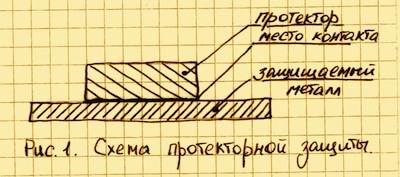
Если на эту конструкцию будет воздействовать внешняя среда, то электроны протектора будут переходить в защищаемый металл и на катоде начнется выделение водорода. Ионы протектора, соединяясь с кислородом (гидроксильными группами OH), вызывают окислительную реакцию, которая приводит к появлению гидроокиси того металла, из которого сделан протектор. Таким образом, обеспечивается катодная защита металла до тех пор, пока протектор полностью не разрушится вследствие коррозии. После полного разрушения начнет корродировать и сам металл.
Среди лакокрасочных материалов выделят класс протекторных грунтовок (цинконаполненных или цинкосодержащих). Применение данного вида материалов получило название «холодное цинкование».
2. Укажите, какие молекулы из перечисленных имеют угловую форму:
H2O, BeCl2, CO2, H2S?
H2O, H2S
3. Определите молярные концентрации ионов Н+ и ОН-; рН и рОН 0,00001 М растворов азотной кислоты и едкого кали, если их степени диссоциации принять равными 1.
Дата добавления: 2015-01-21; просмотров: 6080;
