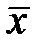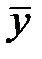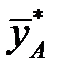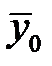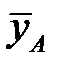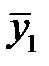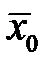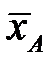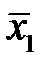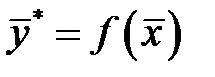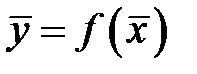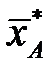Фазовое равновесие
Необходимым условием фазового равновесия является постоянство температуры и давления. Равновесие нарушается при изменении температуры из-за теплообмена, а при изменении давления – из-за массообмена м жду фазами. На равновесие, кроме Р и Т влияет состав фаз.
Фазовое равновесие подчиняется правилу фаз: С = К+2-Ф, где С – число степеней свободы, К – число компонентов, Ф – число фаз. По правилу фаз можно найти число параметров С, при изменении которых сохраняется число или вид фаз.
Например, в случае однокомпонентной трехфазной системы (лед-вода-пар): С = 1+2+3 = 0 и система не имеет степеней свободы. Она существует только при 0.5 кПа 0,0076˚С. Если убрать лед, то С = 1+2-2 = 1 – можно изменять только Т или только Р.
В расчетах по массообмену применяют диаграммы Р = F(концентрация) при T = const; T = F(концентрация) при P = const и концентрация = F(концентрация).
При равновесии достигается зависимость между равновесными концентрациями распределяемого компонента в фазах для данных Р и T (например, между концентрациями NH3 в воде и концентрацией NH3 в воздухе, из которого NH3 поглощается водой):
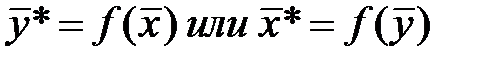 .
.
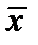 - массовая доля NH3 в воде,
- массовая доля NH3 в воде, 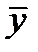 - массовая доля NH3 в воздухе, * - означает равновесие.
- массовая доля NH3 в воздухе, * - означает равновесие.
Графически эти зависимости иллюстрируются линией равновесия. Например, для процесса ректификации бинарной смеси при P = const для компонента А:
t1 и t2 - температура.
При P = const и заданной температуре концентрация компонента А в жидкой фазе отвечает равновесная (предельная) концентрация этого компонента в паровой фазе.
Коэффициент распределения m – отношение равновесных концентраций распределяемого компонента в фазах:
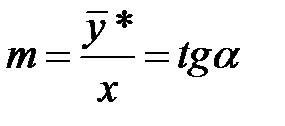 . m равен tgα, α – угол наклона линии равновесия.
. m равен tgα, α – угол наклона линии равновесия.
16.3. 4 Wm6AVyX/v6D6AQAA//8DAFBLAQItABQABgAIAAAAIQC2gziS/gAAAOEBAAATAAAAAAAAAAAAAAAA AAAAAABbQ29udGVudF9UeXBlc10ueG1sUEsBAi0AFAAGAAgAAAAhADj9If/WAAAAlAEAAAsAAAAA AAAAAAAAAAAALwEAAF9yZWxzLy5yZWxzUEsBAi0AFAAGAAgAAAAhAConmZbMBwAA0jUAAA4AAAAA AAAAAAAAAAAALgIAAGRycy9lMm9Eb2MueG1sUEsBAi0AFAAGAAgAAAAhAEJpYVzfAAAACQEAAA8A AAAAAAAAAAAAAAAAJgoAAGRycy9kb3ducmV2LnhtbFBLBQYAAAAABAAEAPMAAAAyCwAAAAA= "> Материальный баланс и рабочая диаграмма массообмена
Зависимость между рабочими концентрациями распределяемого компонента 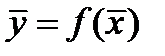 иллюстрируется рабочей линией процесса. В промышленных аппаратах рабочие концентрации не достигают предельных (равновесных) значений.
иллюстрируется рабочей линией процесса. В промышленных аппаратах рабочие концентрации не достигают предельных (равновесных) значений.
Уравнение 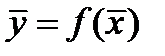 получается из материального баланса процесса. Рассмотрим непрерывный противоточный массообменный аппарат, работающий в режиме идеального вытеснения. Пусть процесс односторонний, например, из газовой фазы в жидкую переходит NH3.
получается из материального баланса процесса. Рассмотрим непрерывный противоточный массообменный аппарат, работающий в режиме идеального вытеснения. Пусть процесс односторонний, например, из газовой фазы в жидкую переходит NH3.
L – расход жидкой фазы (кг/с),
G – расход газовой фазы,
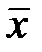 - массовая доля NH3 в жидкой фазе,
- массовая доля NH3 в жидкой фазе,
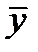 - массовая доля NH3 в газовой фазе,
- массовая доля NH3 в газовой фазе,
н – начало. К – конец.
Материальный баланс аппарата:
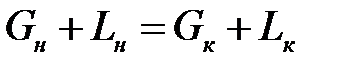 ;
;
Материальный баланс аммиака:
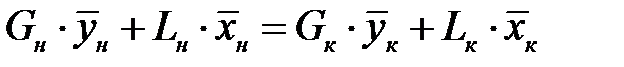 ;
;
Материальный баланс для части аппарата ниже сечения 1-1:
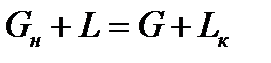 ;
;
по NH3:
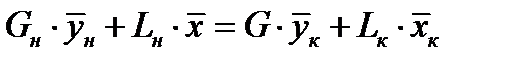 ;
;
Выразим 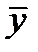 :
:
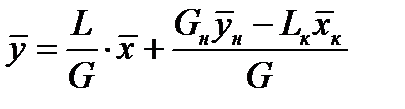 - уравнение рабочей линии
- уравнение рабочей линии  . Оно связывает рабочие концентрации во взаимодействующих встречных фазах по высоте аппарата.
. Оно связывает рабочие концентрации во взаимодействующих встречных фазах по высоте аппарата.
Практически 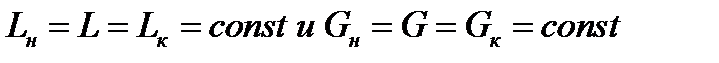 и рабочая линия становится прямой:
и рабочая линия становится прямой: 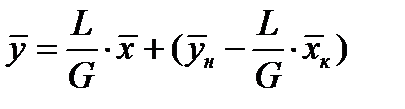 или
или 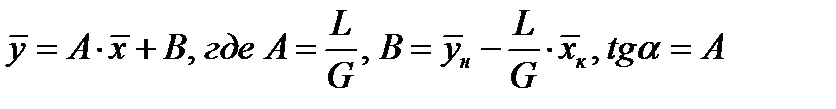 .
.
Для анализа и расчета процесса массообмена надо совместить в одной диаграмме рабочую и равновесную линию.
Рабочая линия может быть ниже или выше равновесной. Распределяемое вещество переходит из фазы, в которой его концентрация выше равновесной 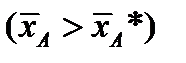 , в фазу, в которой его концентрация ниже равновесной
, в фазу, в которой его концентрация ниже равновесной 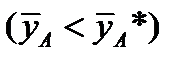 . Т.е. в случае (а)
. Т.е. в случае (а) 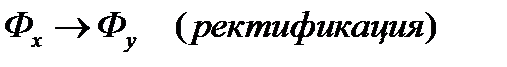 , (б)
, (б) 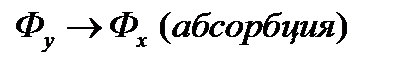 .
.
Дата добавления: 2015-01-19; просмотров: 1201;
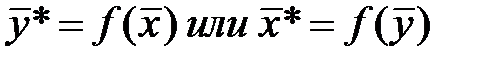 .
.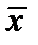 - массовая доля NH3 в воде,
- массовая доля NH3 в воде, 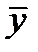 - массовая доля NH3 в воздухе, * - означает равновесие.
- массовая доля NH3 в воздухе, * - означает равновесие.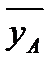
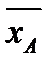
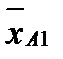
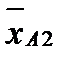
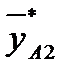
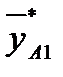
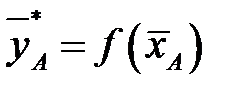
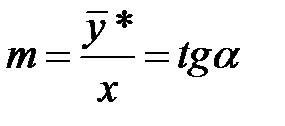 . m равен tgα, α – угол наклона линии равновесия.
. m равен tgα, α – угол наклона линии равновесия.
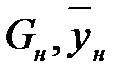
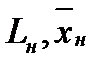
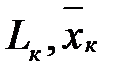
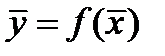 иллюстрируется рабочей линией процесса. В промышленных аппаратах рабочие концентрации не достигают предельных (равновесных) значений.
иллюстрируется рабочей линией процесса. В промышленных аппаратах рабочие концентрации не достигают предельных (равновесных) значений.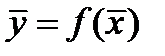 получается из материального баланса процесса. Рассмотрим непрерывный противоточный массообменный аппарат, работающий в режиме идеального вытеснения. Пусть процесс односторонний, например, из газовой фазы в жидкую переходит NH3.
получается из материального баланса процесса. Рассмотрим непрерывный противоточный массообменный аппарат, работающий в режиме идеального вытеснения. Пусть процесс односторонний, например, из газовой фазы в жидкую переходит NH3.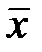 - массовая доля NH3 в жидкой фазе,
- массовая доля NH3 в жидкой фазе,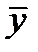 - массовая доля NH3 в газовой фазе,
- массовая доля NH3 в газовой фазе,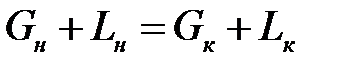 ;
;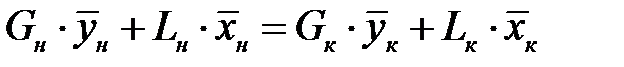 ;
;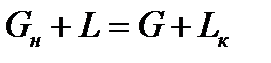 ;
;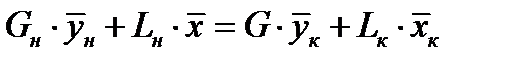 ;
;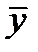 :
: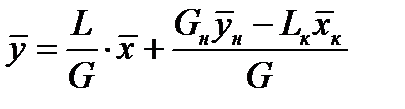 - уравнение рабочей линии
- уравнение рабочей линии  . Оно связывает рабочие концентрации во взаимодействующих встречных фазах по высоте аппарата.
. Оно связывает рабочие концентрации во взаимодействующих встречных фазах по высоте аппарата. и рабочая линия становится прямой:
и рабочая линия становится прямой: 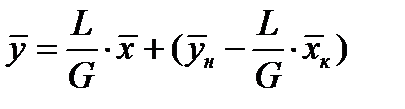 или
или 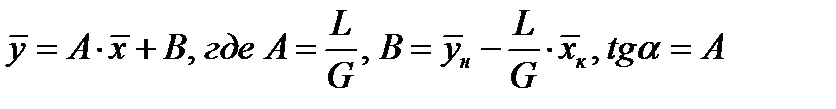 .
.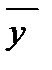
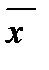
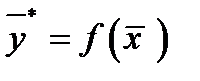
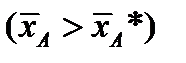 , в фазу, в которой его концентрация ниже равновесной
, в фазу, в которой его концентрация ниже равновесной 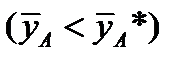 . Т.е. в случае (а)
. Т.е. в случае (а) 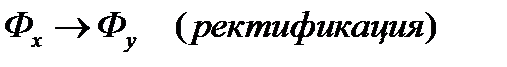 , (б)
, (б) 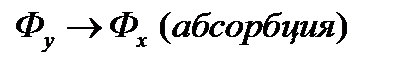 .
.