ПУТЬ БИОСИНТЕЗА
Значительный интерес вызвало открытие синтеза белковых и полипептидных гормонов в виде более крупных предшественников, которые затем путем расщепления модифицируются в более мелкие (рис. 3—4) [4]. На самом деле белковые и полипептидные гормоны составляют только один из многих классов белков, синтезируемых как предшественники. В качестве примеров белков. различных классов могут служить сывороточный альбумин, протеины яичного белка, антитела, коллаген, ферменты поджелудочной железы, вирусные и связанные с мембранами белки. Усилия исследователей в настоящее время сфокусированы на выяснении физиологической роли биосинтетических предшественников на пути образования гормонов, а также общего значения предшественников секретируемых белков.
Одна из вероятных функций последовательности предшественников видна на примере инсулина. С-пептид проинсулина — соединительный пептид, связывающий А- и В-цепи инсулина — принимает участие, по-видимому, в правильной сборке цепей, создавая возможность эффективного образования дисульфидных связей. Такая стабилизирующая функция должна иметь место только применительно к ограниченному числу секретируемых белков, таких, как инсулин, поскольку многие белки существуют в виде одиночных полипептидных цепей, лишенных дисульфидных мостиков.

Рис.3—4. Неполный перечень пребелков различных структурных классов.
Стрелками показаны участки расщеплений, в результате чего предшественники превращаются в промежуточные или окончательные продукты. Не все предшественники для превращения в промежуточные формы пробелков проходят через стадию расщепления (Habener, Potts [4]).
В настоящее время складываются представления в пользу вероятной роли предшественников в посттрансляционных процессах, обусловливающих внутриклеточный транспорт и компартментализацию гормонов по ходу секреторного пути [5, 6]. Эта гипотеза, известная под названием сигнальной, предложена Mistein и сотр. [5], а также Blobel и Sabatini [6] для объясневия молекулярного механизма, с помощью которого белки, предназначенные для секреции из клетки, избирательно получают доступ к окруженным мембранами субклеточным органеллам, участвующими в их транспорте, упаковке и секреции.
На основании модели, приведенной на рис. 3—5, можно объяснить путь биосинтеза паратиреоидного гормона как представителя полипептидных гормонов с учетом положений сигнальной гипотезы. Этот путь включает последовательное расщепление биосинтетических предшественников: препропаратиреоидный гормон (пре-про-ПТГ) ® пропаратиреоидный ® паратиреоидный гормон. Инициация синтеза белка происходит на полирибосомах в матриксе клетки. Инициальная аминокислота (аминокислоты) — метионин, кодируемая специфическим кодоном АУГ, отделяется от растущей полипептидной цепи, когда она достигает в длину примерно 20—30 аминокислот (примерная длина полипептида, покрывающая протяженность крупной рибосомальной субъединицы). Этот процесс считается общим для синтеза всех белков, продуцируемых эукариотами.
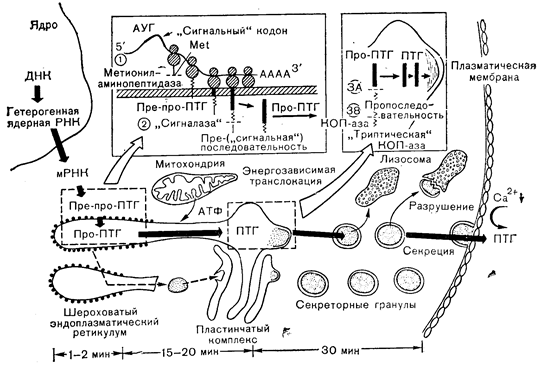
Рис. 3—5. Схематическое изображение пути биосинтеза паратиреоидного гормона.
КОПаза—карбоксипептидаза В (Habener, Potts [4]),
Гидрофобная специфическая для прегормона последовательность пре-про-ПТГ, кодируемая последовательностью оснований мРНК, непосредственно прилегающей (3 -конец) к инициальному кодону АУГ (сигнальные кодоны), выступает затем в роли «водителя» или сигнала, который каким-то, до сих пор не выясненным, образом обеспечивает контакт комплекса полирибосома — синтезируемая цепь с мембраной эндоплазматического ретикулума. Контактируя с этой мембраной либо за счет чисто гидрофобных взаимодействий, либо, что вероятнее, за счет специфических рецепторов мембраны, растущая полипептидная цепь проходит через мембрану во внутрицистернальное пространство. Сразу же после этого или, вероятно, еще в процессе прохождения пре-про-ПТГ в цистерну сигнальная последовательность отщепляется, по-видимому, под действием специфической пептидазы, локализованный в эндоплазматическом ретикулуме, что приводит к образованию про-ПТГ. Этот промежуточный предшественник (про-ПТГ) движется затем по каналам, образованным мембранами эндоплазматического ретикулума, в пластинчатый комплекс, где от него под сочетанным действием ферментов, обладающих активностью, сходной с активностью трипсина и карбоксипептидазы В, отщепляется МНа-концевой гексапептид. Окончательный гормональный продукт включается в секреторные гранулы и высвобождается во внеклеточное пространство в ответ на снижение концентрации кальция во внеклеточной жидкости.
Правильность этой модели подтверждается многими данными» [7—11]. При структурном анализе первичных продуктов трансляции некоторых мРНК, кодирующих различные секретируемые белки, было обнаружено, что многие, если не все, белковые гормоны и секретируемые белки синтезируются вначале в виде предшественников с гидрофобными N1-12-концевыми участками (см. рис. 3—4). По-видимому, препропаратиреоидный гормон [12] является типичным представителем целого класса биосинтетических предшественников (пребелков) белковых гормонов, к которым относятся инсулин, СТГ, пролактин, ТТГ и АКТГ, а также негормональных секретируемых белков, таких, как ферменты поджелудочной железы, протеины яичного белка, иммуноглобулины, сывороточный альбумин, «мелиттин» (или меллитин — пчелиный яд) и некоторые ассоциированные с мембраной бактериальные белки. Характерным для сигнальных последовательностей предшественников является то, что они расположены на NH2-концевой части белков. Эти последовательности различаются по длине, включая от 15 до 25 аминокислотных остатков; в центральных их частях содержится гидрофобный участок, состоящий из 10— 12 аминокислот. Столь высокая степень гидрофобности характерна для белков, известных своим специфическим взаимодействием с мембранами.
Приведенные данные позволяют считать, что обеспечение возможности движения через мембрану — основная функция сигнальной последовательности. Таким образом, благодаря специфическому характеру последовательности предшественника из множества клеточных белков отбираются, отделяются, транспортируются и поступают на секреторный конвейер клетки белки, предназначенные для секреции.
Если в отношении прегормонов или препрогормонов существуют веские доказательства их транспортной функции, то функция промежуточных предшественников—прогормонов—остается неизвестной. Радиоавтографические исследования миграции вновь синтезированных белков в клетке показали, что превращение прогормона в конечные продукты происходит в пластинчатом комплексе клетки. Например, период в 15 мин между началом сип-теза пре-про-ПТГ и первым появлением ПТГ практически совпадает со сроком, необходимым для попадания радиоавтографических гранул в пластинчатый комплекс [13]. Превращение прогормона в гормон может быть также избирательно заблокировано действием на ткани ингибиторов продукции энергии в клетке (антимицин А и динитрофенол), равно как и веществами, нарушающими функцию микротрубочек (винбластин и колхицин). Эти данные указывают на то, что транслокация прогормона из ШЭР в пластинчатый комплекс является энергозависимым процессом, и что в движении прогормона могут принимать участие микротрубочки. Однако отсутствуют прямые доказательства того, что прогормон сам по себе, или его химические взаимодействия, играет существенную роль в транспорте вновь синтезированного белка из ШЭР в пластинчатый комплекс или что он в какой-либо мере определяет упаковку гормона в пузырьки или гранулы. Недавно проведенные исследования, согласно которым синтез многих секретируемых белков не требует образования промежуточных, или проформ предшественников (см. рис. 3—4), порождают определенные сомнения в справедливости такого представления [4]. Непонятно, почему некоторые секретируемые белки, например паратиреоидный гормон, инсулин и сывороточный альбумин, образуются с помощью промежуточных предшественников, тогда как другие, например СТГ, пролактин и овальбумин, не проходят через эту стадию.
Если значение прогормона для клеточного транспорта не известно, то некоторые детали его расщепления уже изучены. В отличие от того, что наблюдается в отношении прегормонов, в которых аминокислотные остатки по месту отщепления сигнальной последовательности от остальной части молекулы (гормона или прогормона) в разных прегормонах неодинаковы (см. рис. 3—4 и 3—5), места расщепления пробелковых интермедиатов постоянно содержат основные аминокислоты лизин или аргинин (или и ту и другую), обычно по 2—3 вместе (см. рис. 3—4). Этот субстрат легко и предпочтительно атакуется эндопептидазами, обладающими трипсиноподобной активностью. После эндопептидазного расщепления оставшиеся основные аминокислоты подвергаются избирательному отщеплению под действием экзопептидаз с активностью, подобной активности карбоксипептидазы В.
Вполне вероятно, что все пробелки расщепляются в ходе общего ферментативного процесса внутри пластинчатого комплекса клеток различного происхождения. Однако роль этого общего процесса расщепления прогормонов, находящихся на секреторном конвейере, остается неизвестной, как и значение самого существования пробелковых интермедиатов некоторых, но не всех, секретируемых белков. Дальнейшее ферментативное расщепление пептида-предшественника, отделившегося от пропаратиреоидного гормона, может представлять собой один из этапов клеточной деградации этого пептида, или, что более вероятно, трипсиноподобная и карбоксипептидазо-В-подобная активности могут быть неразделимыми свойствами единого ферментного комплекса. Не исключено также, что части пептидов-предшественников, отщепляемые от пробелка, могут обладать пока не установленной собственной и самостоятельной биологической активностью, а их дальнейшее расщепление необходимо для проявления этой активности. Такая ситуация, вероятно, складывается в процессе образования АКТГ, b-липотропина и эндорфинов (опиатоподобные пептиды), которые одновременно появляются в результате расщепления общего крупного белкового предшественника [14].
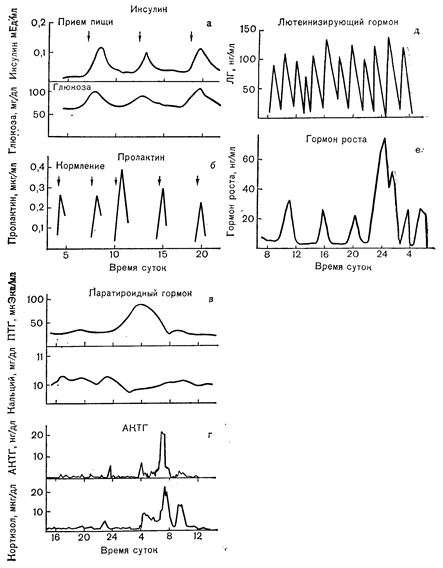
Рис. 3—6, Особенности секреции различных белковых гормонов. Секреция в ответ на специфические внешние стимулы (а, б); циркадный ритм секреции (в, г); «спонтанная» секреция, предположительно возникающая под влиянием ЦНС (д, е) (в— Jubiz W. и соавт., J. Cim. Invest.» 1972,51, 2040; r—Gallager T.F. и соавт., J. din. EndocrinoL Metab., 1973,36, 1058; д— Yen S.S. С. и соавт., J. din. EndocrinoL Metab., 1972,34, 671; е — Finkelstein J.W. и соавт., J. Clin. EndocrinoL Metab., 1972, 35, 665).
Дата добавления: 2015-01-19; просмотров: 1333;
