ПРОИСХОЖДЕНИЕ РЕГУЛЯТОРНЫХ ЛИГАНДОВ
Для того чтобы лиганд мог играть роль в сложной регуляции, прежде всего необходимо, чтобы менялась его концентрация в тех условиях внешней среды, при которых стимуляция регулируемых им биохимических реакций создавала бы преимущества для организма.
Tomkins [1] предположил далее, что регуляторная роль таких лигандов, как цАМФ, могла бы обусловливаться тем обстоятельством, что они накапливаются в качестве побочных продуктов реакций, протекающих обычно с незначительной скоростью, но ускоряющихся в условиях ингибирования основных метаболических превращений предшественников этих лигандов. Например, аденозинтрифосфат (АТФ) обычно превращается в аденозиндифосфат (АДФ) или аденозинмонофосфат (АМФ). Эта реакция может протекать сопряженно с другими, такими, как превращение глюкозы в глюкозо-6-фосфат. В условиях дефицита глюкозы ее фосфорилирование и, соответственно, превращение АТФ в АДФ могло бы тормозиться. При этом большее количество АТФ оказалось бы доступным для альтернативных превращений, таких, как образование цАМФ. В таких условиях цАМФ мог бы становиться «символом» дефицита глюкозы в том смысле, что он накапливался бы при снижении уровня сахара.
Коль скоро существует механизм регуляции уровня лиганда соответствующими стимулами, появляется необходимость создания механизма воздействия лиганда на соответствующую метаболическую реакцию (или реакции). Это предполагает необходимость взаимодействия лиганда с другими молекулами в клетке. Связывающие белки для таких продуктов, как цАМФ, вероятно, уже существовали к моменту появления этих продуктов, поскольку должны были присутствовать ферменты, образующие лиганд при связывании с его предшественниками [1]. Если бы такие белки подверглись модификации, обусловившей приобретение активности (или активностей), позволяющей воздействовать на метаболические реакции, и если бы эта активность (активности) при связывании с лигандом увеличивалась, то налицо были бы все элементы сложной регуляции. Генетические явления (мутация, делеция генной последовательности или включение дополнительных генных последовательностей) могли бы придать генам соответствующих белков способность кодировать синтез молекул с необходимыми регуляторными свойствами. Присутствие регуляторных белков должно обеспечивать любым клеткам преимущество в борьбе за существование, так как они способствуют клеточным реакциям, направленным на преодоление возникающей угрозы (например, дефицит глюкозы), явившейся причиной образования регуляторного лиганда. Например, некоторые бактерии (Escherichia coli) при низкой концентрации глюкозы накапливают цАМФ [I]. Этот нуклеотид стимулирует затем продукцию ферментов, которые метаболизируют другие углеводы, такие, как галактоза и лактоза.
Описанные эффекты поэтому обеспечивают мобилизацию других углеводных ресурсов, которые могут утилизироваться организмом в условиях отсутствия глюкозы. Таким образом, цАМФ — ключевой медиатор действия гормонов и нервных сигналов у человека — возник в качестве регулятора метаболизма у гораздо более просто организованных видов.
Регуляторные лиганды могут становиться символами субстратного дефицита и в других обстоятельствах. Гуанозинтетрафосфат («магическое пятно») регулирует у бактерий белковый обмен [1, 2]. Он образуется из ГТФ, используемого в процессах биосинтеза. белка. Как подчеркнул Tomkins [1], при ограниченной доступности аминокислот на синтез белка должно было бы уходить. меньше ГТФ и поэтому могло было бы образовываться большее количество «магического пятна». Таким путем накопление нуклеозидтетрафосфата могло бы символизировать дефицит аминокислот. Тогда, если только предсуществуют дополнительные элементы регуляторной системы, «магическое пятно» могло бы способствовать смягчению первоначального воздействия (аминокислотного дефицита) за счет, например, стимуляции распада-других белков, являющихся источником аминокислот. Rousseam и Baxter [2] предположили, что в условиях торможения метаболизма или утилизации холестерина по обычным путям может включаться регуляция продукции стероидных гормонов. Рост клеток сопряжен с включением холестерина в состав мембран. Когда в результате действия любого из множества факторов рост оказывается заблокированным, могло бы наблюдаться большее превращение холестерина в другие молекулярные формы, такие, как стероидные гормоны. Таким образом, стероиды могли бы, как это и есть в действительности (особенно в отношении половых стероидов), приобретать значение символов для регуляции роста клеток. Продукцию стероидов могут увеличивать и другие факторы. Возможно, например, что при снижении уровня углеводов (рис. 2—1) и, следовательно, образующегося из них пирувата нарушается утилизация ацетил-СоА в окислительных процессах через цикл лимонной кислоты и в процессах липогенеза. Это могло бы привести к большему поступлению ацетил-СоА в реакцию: ацетил-СоА® холестерин® стероиды. Такая последовательность событий могла бы объяснить, каким образом глюкокортикоиды стали символами дефицита глюкозы [2] и приобрели роль в метаболизме, которую они играют ныне, повышая продукцию глюкозы и увеличивая содержание сахара за счет торможения его поглощения некоторыми тканями. У человека глюкокортикоиды в регуляции углеводного обмена играют гораздо меньшую роль, чем такие гормоны, как инсулин и глюкагон. Однако хотя продукция глюкокортикоидов у человека и не очень чутко реагирует на изменение уровня сахара в крови, тяжелая гипогликемия все же приводит к резкому увеличению секреции этих стероидов, а у других животных (лосось) глюкокортикоиды играют более важную роль в регуляции уровня сахара в крови [2, 3].
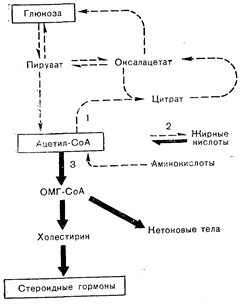
Рис.2—1. Метаболические взаимосвязи между глюкозой, ацетил-СоА и стероидными гормонами. Цифрами обозначены три главные пути превращения ацетил-СоА. Жирные и пунктирные стрелки указывают соответственно на преимущественные и минорные метаболические превращения в условиях дефицита глюкозы.
ОМГ-СоА — оксиметилглютарил-СоА (Baxter, Rousseau [2]).
Конечно, не все символы, контролирующие метаболизм, регулируются простым увеличением их синтеза. В регуляции гомеостаза большое участие принимают и ионы, такие, как Са24 , Mg2+, К+ и Сl– (см. главу 4). В этих случаях изменения метаболизма приводят не к образованию ионов, а к изменению их концентрации в некоторых клеточных пространствах (цитозоле, митохондриях, саркоплазматическом ретикулуме и др.). Например, дефицит глюкозы или других субстратов мог бы обусловливать нехватку АТФ или изменение соотношения АТФ/АДФ, что в свою очередь должно было бы влиять на активность транспортных систем, участвующих в поддержании ионных концентрационных градиентов по обе стороны мембраны. Взаимодействуя с определенными белками, как было описано, ионы затем могли бы приобрести регуляторную роль.
Дата добавления: 2015-01-19; просмотров: 985;
