Химические свойства моносахаридов
Знание химических свойств моносахаридов необходимо для понимания путей превращения этих важнейших биоактивных соединений в организме и участия их в метаболических процессах.
1. цикло-оксотаутомерия( кольчато-цепная таутомерия) и мутаротация
2. изомеризация , эпимеризация
3. образование аминогруппы у атома С 2.
4. образование гликозидов
5. образование сложных эфиров
6. реакции окисления
7. реакции восстановления
9.4.1. Цикло-оксотаутомерия
Моносахариды существуют в форме альдегидов( кетонов) и циклических внутренних
Полуацеталей( полукеталей).
Присутствие двух групп - карбонильной и гидроксильной - в молекуле моносахарида делает возможным протекание внутримолекулярной реакции нуклеофильного присоединения А N, которая сопровождается образованием циклического полуацеталя
( полукеталя).
полуацетальный ( гликозидный)
H Н гидроксил
| |

 ——С= О ——— *С — ОН атом углерода хиральный
——С= О ——— *С — ОН атом углерода хиральный

 <———> возникают 2 зеркальных
<———> возникают 2 зеркальных
А N изомера
————— О — Н ——— О
циклическая форма ( полуацеталь )
Два процесса приводят к образованию циклического соединения:
А) нуклеофильная атака кислорода по атому углерода карбонильной группы
Б) атом водорода присоединяется к кислороду карбонильной группы
Появляется спиртовая группа вместо карбонильной.
Возникают два зеркальных изомера, т.к. возникает новый хиральный центр. Такие зеркальные циклические изомеры называются аномерами.
Гидроксильная полуацетальная группа в аномерном центре углевода в циклической форме называется гликозидной, аномерной.
аномерные гидроксигруппы( выделены жирным шрифтом)
Н ОН НО Н
 \ / \ / .
\ / \ / .
С С

 / \ / \
/ \ / \
цикл цикл
Зеркальная изомерия циклической формы моносахарида
Устойчивыми являются пятичленные и шестичленные циклические формы.
Пятичленные формы носят название фуранозы( фуранозные циклы) ( по аналогии с пятичленным циклическим соединением фураном)
Шестичленные циклы носят название пиранозы ( пиранозные циклы )
Все альдопентозы : рибоза , дезоксирибоза и др. и кетогексоза фруктоза in vivo
присутствуют в форме фуранозы( in vitro возможно образование и пиранового цикла). Фуранозный цикл плоский.
Альдогексозы глюкоза , галактоза, манноза образуют in vivo шестичленные пирановые циклы (in vitro возможно также образование фуранового цикла )
Пиранозный цикл может быть, как и циклогексан , в двух пространственных формах : кресло и ванна. В природных соединениях пиранозные циклы имеют конформацию кресло.
Пиранозные циклы более устойчивы к размыканию по сравнению с фуранозными.
В циклической и нециклической форме число гидроксильных групп одинаковое, но в циклической форме исчезает карбонильная группа. Вместо нее образуется гидроксильная группа, которую называют полуацетальной ( гликозидный гидроксил). Два зеркальных циклических изомера по атому углерода С1 обозначают двумя символами- а- и β .
Два циклических изомера моносахарида, отличающихся только пространственным расположением полуацетального гидроксила, носят название аномеров : а-аномер и
Β- аномер.
Циклические формы моносахаридов записывают , используя два различных вида структурных формул: Колли- Толленса и Хеуорса.
Формулы Колли- Толленса образуются из проекций Фишера, в настоящее время они применяются крайне редко, но зато поясняют, как происходит циклизация. От формулы Колли-Толленса зная особые правила, легко перейти к формуле Хеуорса.
Цикло –оксотаутомерия гексоз.
Глюкоза



 | |
| |
 Н О-1С-Н Н - С = О Н - 1С -ОН
Н О-1С-Н Н - С = О Н - 1С -ОН
| | |
Н -2C- ОН Н -C- ОН Н -C- ОН
| | |

 НО-3С-Н О НО-С-Н НО-С-Н О
НО-3С-Н О НО-С-Н НО-С-Н О
| | |
Н -4C- ОН Н -C- ОН Н -C- ОН
| | |



 Н -5C Н-С-ОН Н-С | | | |
Н -5C Н-С-ОН Н-С | | | |
СН2 ОН СН2 ОН СН2 ОН
А Б
β- аномер схема а-аномер
β – D- глюкопираноза циклизации а- D -глюкопираноза
Атом кислорода гидроксильной группы у С5 нуклеофильно атакует атом углерода карбонильной группы, атом водорода этой гидроксильной группы переходит к атому кислорода карбонильной группы – замыкается цикл( атом кислорода атома С5 рисуют в середине цикла)
У атома С1 возникает гидроксильная группа- полуацетальный, гликозидный гидроксил. ( на схеме формулы А и Б, гидроксильная группа выделена жирным шрифтом)
В циклических формах атом С1 тетраэдрический, связан с четырьмя разными группировками , возникает новый хиральный центр , который обусловливает существование двух изомеров- а- и β-аномеров. Атом С1 принято называть «аномерным»
Аномер, в котором полуацетальный гидроксил расположен также, как гидроксильная группа, определяющая стереоряд ( справа от оси молекулы), является а-аномером ; если полуацетальный гидроксил расположен по другую сторону ( слева) - β-аномер.
Для построения формул Хеуорса следует нарисовать шестичленный цикл, поставить циклический атом кислорода в определенном месте(правый верхний угол, это положение не нумеруется), нарисовать вертикальные связи у каждого атома углерода и те группы, которые в формуле Колли-Толленса были справа( d- конфигурация) написать под плоскостью цикла, а те , что были слева ( l- конфигурация) написать над плоскостью цикла.
Упрощенное правило: что справа -то внизу, что слева – то вверху ( удобно запомнить, в каждой паре двух слов одна буква «р» ).
На рисунке изображена а –D - глюкопираноза ( формула Хеуорса )
 d
d 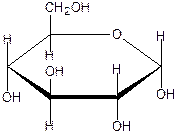 полуацетальный
полуацетальный
l d гидроксил в а-форме направлен «вниз»
На следующем рисунке представлены оксоформа D-галактозы и циклоформа : а –D
глюкопираноза.( внимательно рассмотрите и сравните расположение всех гидроксигрупп в обеих формулах и гликозидного гидроксила )

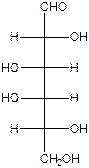 d
d 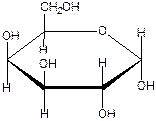 полуацетальный
полуацетальный
D – галактоза (d l l d) l d гидроксил
а- D- галактопираноза
Цикло –оксотаутомерия пентоз и кетогексоз
Альдопентозы и кетогексозы в биологических соединениях образуют фуранозные пятичленные циклы. Все ранее отмеченные особенности и правила записи формулы Хеурса сохраняются.
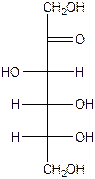
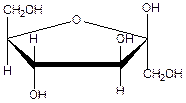 β - полуацетальный
β - полуацетальный
D- фруктоза ( d d l) d l гидроксил
β - D- фруктофураноза
В растворе рибоза существует в четырех формах: - пиранозных и фуранозных. Доля менее устойчивых фуранозных форм ниже 25%, но во всех природных соединениях: нуклеотидах, нуклеиновых кислотах, АТФ, рибоза и дезоксирибоза находятся только в β - аномерной фуранозной форме, что увеличивает внутренний запас энергии соединения и его реакционную способность.
Мутаротация ( изменение вращения)
В растворах устанавливается равновесие между всеми возможными формами: оксо и циклическими ( а и β ).
Кристаллическая глюкоза а-D- глюкопираноза имеет коэффициент удельного вращения
[ а ] =1120 , а у кристаллической β- D- глюкопиранозы [ а ] =190. В растворе каждый из аномеров превращается в другой и устанавливается равновесная смесь обоих аномеров
[ а ] = 530 До наступления равновесия значение [ а ] изменяется, это явление получило название мутаротации
а-аномер <—> оксоформа <—> β-аномер
около 36 % 0,02% около 64%
β-Аномерная форма более устойчива, т.к. гликозидный гидроксил может образовать водородную связь с атомом кислорода в пиранозном цикле.
 Н – О β-аномерная форма
Н – О β-аномерная форма
 ———О
———О


Н
Альдозы в циклической форме сохраняют свойства карбонильных соединений, в том числе качественные реакции, позволяющие обнаружить присутствие альдегидной группы.
9.4. 3. Фосфорные эфиры
Все моносахариды в клетке существуют в виде фосфорных эфиров, которые образуются в ферментативных реакциях с участием АТФ
Рибоза + АТФ ———> рибозо -5- фосфат
Глюкоза + АТФ ———> глюкозо -6- фосфат
Галактоза + АТФ ———> галактозо -6- фосфат
Возможен перенос фосфатной группы из одного положения в другое в обратимой реакции изомеризации
Глюкозо-6-ф <———> Глюкозо-1-ф ( аномеры а и β )
Фосфорные эфиры гидролизуются in vitro и in vivo
Глюкозо-6-фосфат + Н2О ———> глюкоза + Н3 РО4
Дата добавления: 2015-03-26; просмотров: 1309;
