Современные представления о строении бензола
Рентгеноструктурный анализ кристаллов бензола обнаружил, что молекула бензола
• имеет плоское ( планарное) строение
• правильный шестичленный цикл
|• углы между всеми связями равны 120
• длина всех связей С-С одинаковая , равна 1,39А и имеет среднее значение
между длиной одинарной связи 1,54А и длиной двойной связи 1,34 .
Эти научные данные следует объяснить образованием общей электронной системы, состоящей из 6 электронов (ароматический секстет ) . Электронная плотность равномерно распределена между атомами углерода, которые находятся в sp2-гибридном состоянии. Максимум электронной плотности негибридизованных р-орбиталей находится над и под плоскостью бензольного кольца.
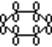
 s-скелет лежит в плоскости
s-скелет лежит в плоскости
рZ-АО (Sp2) располагаются перпендикулярно этой плоскости и параллельно друг другу, образуя единое делокализованное электронное облако из 6 электронов, максимум электронной плотности р-электронов располагается над и под плоскость s-скелета.
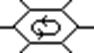
Образование общей π-электронной системы в бензоле относится к явлению делокализации.
Устойчивость бензола за счет делокализации электронов повышается на 36,6 ккал\моль( 150 кдж\моль). Эта величина носит название - энергия делокализации
( энергия резонанса) . Возникает повышенная термодинамическая устойчивость.
Повышенной термодинамической устойчивостью , а следовательно, и ароматическими свойствами обладают только те циклические соединения, которые имеют :
• плоское строение
• сопряженную систему связей
•число π -электронов в сопряженной системе N(π ) = 4n+2 , где n-целое число 1,2,3.4 и т.д., получаются значения N= 6, 10, 14, 18 и т. д.
Формула N(π ) = 4n+2 носит название « правило Хюккеля».
Ароматические свойства сохраняют гомологи и производные бензола, содержащие один или несколько заместителей в бензольном кольце.
Правило Хюккеля применимо и для полиядерных углеводородов с конденсированными циклами. К ним следует отнести нафталин
( 10 π -электронов, 5 двойных связей) , изомеры фенантрен и антрацен ( 14 π -электронов, 7 двойных связей). В отличие от бензола в этих циклах нет равномерного распределения электронной плотности.
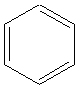 Бензол
Бензол
| 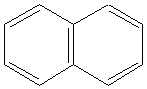 Нафталин
Нафталин
|
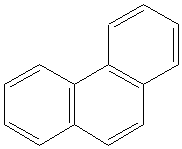 Фенантрен
Фенантрен
| 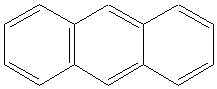 Антрацен
Антрацен
|
Дата добавления: 2015-03-26; просмотров: 1073;
