Гидролиз солей. Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды.
Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды.
Гидролиз является обратимым процессом. В реакциях гидролиза участву-
ют ионы слабых электролитов: катионы слабых оснований и анионы слабых кислот. Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O 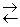 H+ + OH— ; в результате среда становится либо кислой (рН < 7), либо щелочной (pH > 7).
H+ + OH— ; в результате среда становится либо кислой (рН < 7), либо щелочной (pH > 7).
· Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (pH > 7). Первая ступень гидролиза: Na2CO3 + HOH 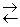 NaHCO3 + NaOH; CO32— + HOH
NaHCO3 + NaOH; CO32— + HOH 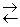 HCO3– + OH—
HCO3– + OH—
· Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону. Реакция среды кислая (pH < 7).
Первая ступень гидролиза:
Cu(NO3)2 + HOH 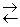 CuOHNO3 + HNO3 Cu2+ + HOH
CuOHNO3 + HNO3 Cu2+ + HOH 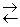 CuOH+ + H+
CuOH+ + H+
· Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется константами диссоциации образовавшихся слабых электролитов.
CH3COONH4 + HOH 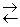 CH3COOH + NH4OH
CH3COOH + NH4OH
CH3COO— + NH4+ + HOH 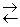 CH3COOH + NH4OH
CH3COOH + NH4OH
· При совместном гидролизе двух солей образуются слабое основание и слабая кислота: 2FeCl3 + 3Na2S +6H2O = 2Fe(OH)3 ¯ + 3H2S + 6NaCl
2Fe3+ + 2S2— + 6H2O = 2Fe(OH)3 ¯ + 3H2S
· Соль, образованная сильной кислотой и сильным основанием, гидролизу
не подвергается, реакция среды нейтральная: KNO3 + HOH ¹
Ионы K+ и NO3— не образуют с водой слабодиссоциирующих продуктов (KOH и HNO3 – сильные электролиты).
Дата добавления: 2015-01-15; просмотров: 2780;
