Теоретическое введение. Среди различных тепловых свойств важное место занимает теплоемкость , под которой для тела (или системы тел) понимают отношение
Среди различных тепловых свойств важное место занимает теплоемкость 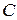 , под которой для тела (или системы тел) понимают отношение
, под которой для тела (или системы тел) понимают отношение
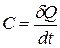 , (22.1)
, (22.1)
где 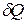 - бесконечно малое количество теплоты, полученное системой при повышении температуры на
- бесконечно малое количество теплоты, полученное системой при повышении температуры на 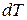 .
.
Средняя теплоемкость 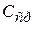 в интервале температур от
в интервале температур от 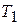 до
до 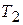 может быть представлена таким образом:
может быть представлена таким образом:
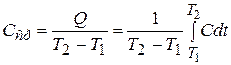 , (22.2)
, (22.2)
где 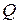 – количество теплоты, за счет получения которой температура системы повысилась от
– количество теплоты, за счет получения которой температура системы повысилась от 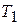 до
до 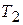 .
.
Так как количество сообщенной теплоты зависит от характера процесса (от пути процесса), определений (22.1) и (22.2) недостаточно, и необходимо указать, каким именно способом повышается температура. Действительно, если температура тела повышается вследствие адиабатического процесса, то  и
и 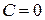 . Если в системе происходит изотермический процесс, то
. Если в системе происходит изотермический процесс, то 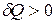 или
или 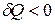 , а
, а 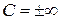 .
.
Обычно на опыте имеют дело с двумя видами теплоемкостей: при постоянном давлении – 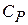 , и при постоянном объеме –
, и при постоянном объеме – 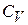 :
:
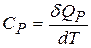 ,
, 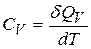 . (22.3)
. (22.3)
Здесь 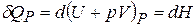 ,
,  – энтальпия, а
– энтальпия, а 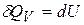 ,
, 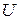 – внутренняя энергия, а
– внутренняя энергия, а 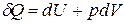 – первое начало термодинамики.
– первое начало термодинамики.
Таким образом, теплоемкости 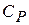 и
и  есть частные производные от энтальпии и внутренней энергии по температуре (при постоянных давлении и объеме). Уравнения
есть частные производные от энтальпии и внутренней энергии по температуре (при постоянных давлении и объеме). Уравнения
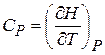 и
и 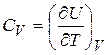 (22.4)
(22.4)
можно рассматривать как определения. Они не имеют прямого отношения к теплоте и характеризуют зависимость энтальпии и внутренней энергии от температуры в условиях постоянного давления или объема и позволяют найти энтальпию или внутреннюю энергию системы при любой температуре, если известны 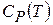 и
и 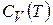 .
.
Теплоемкости 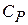 и
и 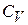 связаны между собой простым термодинамическим соотношением:
связаны между собой простым термодинамическим соотношением:
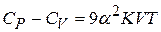 (22.5)
(22.5)
где 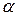 – температурный коэффициент линейного расширения,
– температурный коэффициент линейного расширения, 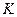 – модуль всестороннего сжатия (см. определение в работе 1-21),
– модуль всестороннего сжатия (см. определение в работе 1-21), 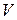 – объем тела,
– объем тела, 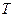 – температура.
– температура.
Относительная величина разности 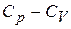 для твердых тел невелика и ею можно пренебречь при невысоких температурах. Напомним, что в газах это не так:
для твердых тел невелика и ею можно пренебречь при невысоких температурах. Напомним, что в газах это не так: 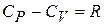 .
.
 Чтобы теплоемкость вещества не зависела от массы тела, вводят понятие удельной
Чтобы теплоемкость вещества не зависела от массы тела, вводят понятие удельной 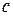 и молярной
и молярной 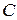 теплоемкостей. Удельная теплоемкость измеряется в
теплоемкостей. Удельная теплоемкость измеряется в 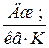 , а молярная – в
, а молярная – в 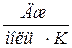 . Из соображений размерности ясно, что
. Из соображений размерности ясно, что 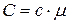 , где
, где 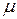 – молярная масса вещества.
– молярная масса вещества.
Экспериментальные факты, относящиеся к теплоемкости типичных неорганических, химически простых, одноатомных кристаллических тел, можно свести к следующим пунктам.
1. При комнатных температурах значения теплоемкости таких веществ близки к 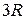 , т.е.
, т.е. 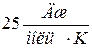 . Это так называемый закон Дюлонга – Пти.
. Это так называемый закон Дюлонга – Пти.
2. При низких температурах теплоемкость заметно уменьшается и в области абсолютного нуля температур приближается к нулю (рис. 22.1).
Эту особенность температурной зависимости теплоемкости твердого тела при низких температурах можно объяснить только с помощью квантовой теории (модели Эйнштейна и Дебая).
Дата добавления: 2015-03-19; просмотров: 539;
