Теоретическое введение. Теплота , приданная системе (телу), расходуется на изменение ее внутренней энергии и на совершение работы .
Теплота 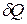 , приданная системе (телу), расходуется на изменение ее внутренней энергии
, приданная системе (телу), расходуется на изменение ее внутренней энергии 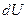 и на совершение работы
и на совершение работы  .
.
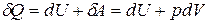 (20.1)
(20.1)
Уравнение (20.1) – первое начало термодинамики. Символ 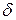 (в некоторых учебниках используется обозначение
(в некоторых учебниках используется обозначение 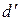 ) указывает на то, что бесконечно малые изменения
) указывает на то, что бесконечно малые изменения 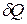 и
и  не являются полными дифференциалами, то есть количество теплоты
не являются полными дифференциалами, то есть количество теплоты 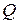 и работа
и работа 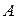 зависят от пути процесса, по которому изменяется состояние системы. Только внутренняя энергия
зависят от пути процесса, по которому изменяется состояние системы. Только внутренняя энергия 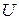 является функцией состояния системы и от пути процесса не зависит.
является функцией состояния системы и от пути процесса не зависит.
При поглощении веществом теплоты 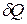 его температура, как правило, увеличивается. Отношение
его температура, как правило, увеличивается. Отношение 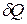 к повышению температуры
к повышению температуры 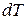 называется теплоемкостью вещества
называется теплоемкостью вещества 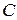
 (20.2)
(20.2)
Так как величина 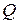 зависит от характера процесса, то и теплоемкость
зависит от характера процесса, то и теплоемкость 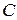 от пути процесса зависит. Поэтому при определении теплоемкости необходимо указывать, каким именно способом изменяется температура. Часто встречающиеся виды процессов – при постоянном объеме (
от пути процесса зависит. Поэтому при определении теплоемкости необходимо указывать, каким именно способом изменяется температура. Часто встречающиеся виды процессов – при постоянном объеме (  ) – изохорический и при постоянном давлении (
) – изохорический и при постоянном давлении (  ) – изобарический. Соответствующие им теплоемкости обозначают
) – изобарический. Соответствующие им теплоемкости обозначают  и
и 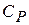 .
.
Для газов эти величины связаны друг с другом простым образом. По определению
 ,
,  . (20.3)
. (20.3)
Из (20.1) 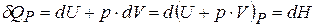 ,
, 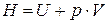 – энтальпия, или теплосодержание.
– энтальпия, или теплосодержание.
При постоянном объёме 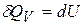 , так как работа
, так как работа 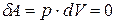 .
.
Отсюда следует, что теплоемкости 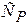 и
и 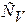 есть частные производные от энтальпии и внутренней энергии по температуре (при постоянных давлении и объеме соответственно). Уравнения
есть частные производные от энтальпии и внутренней энергии по температуре (при постоянных давлении и объеме соответственно). Уравнения
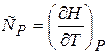 и
и 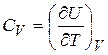 (20.4)
(20.4)
можно рассматривать как определения. Они позволяют найти  и
и 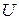 термодинамической системы, если известны зависимости
термодинамической системы, если известны зависимости 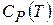 или
или 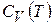 .
.
Каждое состояние термодинамической системы характеризуется совокупностью значений физических величин, отражающих ее свойства. Величины, имеющие простую физическую природу и допускающие непосредственное измерение (давление 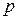 , температура
, температура 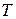 , объем системы
, объем системы 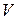 ), используют в качестве параметров состояния. Уравнением состояния называют выражение, связывающее эти параметры. Для однородных систем постоянного состава оно имеет вид
), используют в качестве параметров состояния. Уравнением состояния называют выражение, связывающее эти параметры. Для однородных систем постоянного состава оно имеет вид
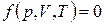 (20.5)
(20.5)
У идеальных газов особенно простое уравнение состояния
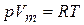 , (20.6)
, (20.6)
где 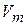 – объем одного моля;
– объем одного моля;  – универсальная газовая постоянная.
– универсальная газовая постоянная.
Используя определение теплоемкости (20.3), первое начало термодинамики и уравнение состояния для газов, можно записать для идеальных газов в расчете на один моль:
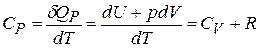 , (20.7)
, (20.7)
так как 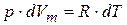 при
при  . Уравнение (20.7) называют соотношением Майера.
. Уравнение (20.7) называют соотношением Майера.
Если применить первое начало термодинамики (20.1) для описания адиабатического расширения (сжатия) идеального газа (  ; изменение состояния без теплообмена), учитывая определения:
; изменение состояния без теплообмена), учитывая определения:
 ,
, 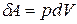 ,
,
соотношение Майера  и введя обозначение
и введя обозначение 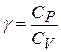 (адиабатическая постоянная), то получим уравнение
(адиабатическая постоянная), то получим уравнение
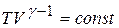 (20.8)
(20.8)
Из него следует, что при адиабатическом процессе температура 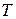 и объем
и объем 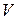 идеального газа меняются таким образом, что произведение
идеального газа меняются таким образом, что произведение 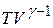 остается постоянным. Поскольку
остается постоянным. Поскольку 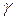 всегда больше единицы, то
всегда больше единицы, то 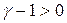 и, адиабатическое расширение сопровождается охлаждением, а сжатие – нагреванием газа. Комбинируя уравнение (20.8) с (20.6), можно получить соотношение, связывающее параметры
и, адиабатическое расширение сопровождается охлаждением, а сжатие – нагреванием газа. Комбинируя уравнение (20.8) с (20.6), можно получить соотношение, связывающее параметры 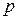 и
и 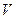 при адиабатическом процессе
при адиабатическом процессе
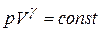 (20.9)
(20.9)
Это равенство называется уравнением Пуассона. Еще одно уравнение для адиабатического процесса связывает параметры 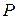 и
и 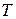
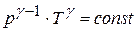
Величина 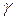 для газов играет большую роль при адиабатических процессах. В частности, этой величиной определяется скорость распространения звука в газах; от нее зависит течение газов по трубам со звуковыми скоростями.
для газов играет большую роль при адиабатических процессах. В частности, этой величиной определяется скорость распространения звука в газах; от нее зависит течение газов по трубам со звуковыми скоростями.
Дата добавления: 2015-03-19; просмотров: 602;
