Химиотерапевтические средства, используемые для системного лечения рака
Цитотоксические препараты. Облучение и хирургические методы лечения применяются для уменьшения массы опухоли при ее локализации в доступных для лучевого воздействия и иссечения областях человеческого организма. Ни тот, ни другой метод не пригоден для воздействия на широко рассеянные или циркулирующие опухолевые клетки, которые так характерны для большинства злокачественных новообразований. Толчком к развитию системного противоопухолевого лечения послужили открытия антибиотиков, используемых, для лечения бактериальных инфекций, и антипротозойных противомалярийных средств. Развитие лекарственной терапии рака началось со случайного обнаружения цитотоксического действия на лимфоциты горчичных газов, применявшихся во время I и II мировых войн. Противоопухолевое вещество—азотистый иприт (производное горчичного газа иприта) использовалось для лечения лимфом в 40-х годах. Так как у лиц, страдающих болезнью Ходжкина и лимфоцитарными лимфомами и, -казалось бы, с успехом леченных азотистым ипритом, впоследствии наблюдали рецидивы заболевания., возникли разочарование и скептицизм в отношении эффективности медикаментозной терапии опухолей. Вновь появившиеся надежды на химиотерапию связаны с эффективным применением антиметаболита метотрексата при лечении лейкозов у детей, а затем и хорошие 'результаты лечения хорионкарциномы. Ремиссии, достигнутые с использованием метотрексата, имели стойкий характер. В 50-х' годах была осознана необходимость стандартизации в развитии и производстве противоопухолевых средств. С. тех пор было открыто множество синтетических, ферментных и растительных веществ, обладающих противоопухолевым эффектом при новообразованиях у грызунов. Эти соединения были получены как целенаправленным синтезом, так и случайным путем. В настоящее время существует шесть основных классов противоопухолевых веществ: алкилирующие вещества, антиметаболиты, растительные алкалоиды, противоопухолевые, антибиотики, гормоны, биологически активные вещества, а также смешанные формы. Все эти средства или уже используются в качестве коммерческих препаратов, или проходят фазу клинических испытаний. Перечень этих препаратов с описанием возможных острых и хронических токсических эффектов приведен в табл. 79-1 и 79-2. Детальное обсуждение механизмов их фармакологического действия дано в ссылках на литературные источники.
Развитие лекарственной устойчивости. Пределы возможностей хирургического метода лечения злокачественных опухолей определяются объемом нормальной ткани, который можно удалить без ущерба для функции органа. Устойчивость к лучевому воздействию зависит от радиационной толерантности прилежащих к опухоли нормальных тканей, в то время как применению противоопухолевых препаратов в очень больших дозах препятствует не только их токсическое воздействие на нормальные ткани, но и то обстоятельство, что сами опухолевые клетки обладают резистентностью (временной или постоянной) к воздействию противоопухолевых средств. Временная резистентность может быть связана с тем, что клетки опухоли находятся в разных фазах клеточного цикла деления, в зонах, недоступных для действия, лекарственных средств (например, центральная нервная система или яичко), или в центре слабоваскуляризованных новообразований, т. е. участках, недосягаемых для активной дозы препарата. Стойкая резистентность объясняется особенностями механизмов транспортировки лекарственных веществ в организме человека, их дезактивации и восстановления ущерба, нанесенного действием химиопрепаратов. Способы преодоления временной резистентности были успешно разработаны и включают в себя: начало лечения опухолевого заболевания на ранних этапах его развития, преодоление фармакологического барьера с помощью введения лекарственных веществ непосредственно в пораженный орган (например, внутриоболочечное введение метотрексата при лейкозе) и, наконец, в уменьшении массы опухолевых клеток путем применения лучевой терапии или хирургического вмешательства. Последний путь преодоления лекарственной устойчивости применяется при раке яичника и включает в себя удаление большого сальника. По-видимому, уменьшение массы опухоли повышает чувствительность раковых клеток к последующему терапевтическому воздействию. Попытки объяснить обратную зависимость между излечимостью процесса и количеством опухолевых клеток особенностями клеточной кинетики при инвазивных образованиях успеха не имели, так как в этих случаях резистентность развивается при увеличении числа опухолевых клеток с 103 до 108. В этом интервале кинетика клеточного цикла остается постоянной. В дальнейших исследованиях влияния химиотерапии на течение опухолевого процесса у человека было показано, что польза этого вида воздействия на ранних стадиях развития рака несколько больше, чем при применении тех же препаратов у больных с развернутой клинической картиной заболевания вне зависимости от благоприятной кинетики в микрометастазах.
В 1979г. Goldie и Goldman предположили, что механизм развития стойкой резистентности к противоопухолевым препаратам имеет много общего с развитием резистентности бактерий к бактериофагу и является спонтанным генетическим эффектом. В этой модели есть несколько существенных моментов. Во-первых, существует теснейшая связь между вероятностью уменьшения излечимости и скоростью увеличения массы опухоли, необходимой для 6-кратного удвоения или 2-х log увеличения количества опухолевых клеток. Если скорость мутации будет равна 10–6 или выше, то почти несомненным будет образование одной или двух клеточных линий, резистентных к химиопрепаратам при размере опухоли 109, размере, при котором злокачественное новообразование становится клинически выявляемым. Этот факт позволяет предположить, что неэффективность противоопухолевых средств зависит от существования множества резистентных опухолевых клеточных линий. Если уровень мутаций ниже 10–6 абсолютное число резистентных клеточных линий в опухоли будет достаточно низким для получения хорошего эффекта хотя бы на первых этапах химиотерапии. В принципе были бы возможны и полные ремиссии, но резистентные клеточные линии могут увеличиваться в объеме и вызывать рецидивы заболевания при продолжающемся воздействии химиотерапии (рис. 79-2). Это вполне согласуется с клиническими наблюдениями опухолей, поддающихся лечению на начальных этапах химиотерапии и вновь восстанавливающихся при продолжающемся ее воздействии. Уровень мутаций у бактерий — случайное явление, что, вероятно, справедливо и для генетически нестабильных опухолевых клеток. У опухолей одного и того же типа и одной стадии процесса уровень мутаций может быть различным, от чего, вероятно, в немалой степени и зависит эффект проводимого лечения и различная выживаемость у однородной группы больных (с одинаковой стадией заболевания и опухолями одного и того же гистологического типа).
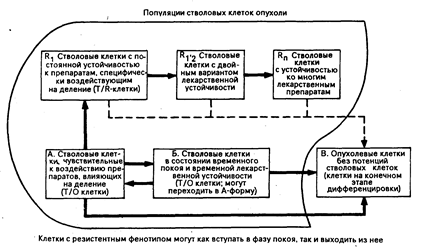
Рис. 79-2. Популяционный состав и взаимоотношения между популяциями в гипотетической опухоли.
Многолетней загадкой является резистентность к химиотерапии новообразований внутренних органов у взрослых по сравнению с опухолями у детей или новообразованиями кроветворной системы. Причем при многих опухолях внутренних органов вообще не наблюдается эффекта от химиотерапии. И хотя на первый взгляд это вовсе не согласуется с гипотезой Goldie—Goldman, существует несколько объяснений этому явлению. Во-первых, опухолевые клетки могут иметь врожденную устойчивость к химиопрепаратам, свойственную нормальным тканям, послужившим источником развития опухоли. Они могут сохранять механизмы детоксикации природных токсинов, из которых были получены многие противоопухолевые средства. Во-вторых, уровень мутаций развившихся из этих тканей опухолей может быть достаточно высоким в результате воздействия потенциальных канцерогенов, таких как курение и др. В-третьих, впечатление о том, что опухоль диаметром 1 см прошла 30 удвоений для того, чтобы достигнуть 109 клеток (рис. 79-3), основывается на предположении об экспоненциальном характере роста, довольно редком явлении в опухолях человека и животных. Так как во многих хорошо изученных опухолях внутренних органов человека потеря клеток составляет 90%, то требуется ни много ни мало 1200 удвоений, чтобы опухоль достигла размера, равного 109 клеток. Если резистентность действительно связана с мутацией и определяется числом клеточных делений, то такие опухоли к моменту постановки клинического диагноза будут состоять из большого количества клеточных линий, резистентных ко множеству химиотерапевтических агентов. Эти факты согласуются с клиническими данными о времени удвоения таких высокорезистентных опухолей человека, как рак толстой кишки, для которой время удвоения составляет около двух лет. Клинические подтверждения теории Goldie—Goldman достаточно основательны. Во-первых, это единственное приемлемое объяснение эффективности комбинированной химиотерапии и неизмененной обратной связи между числом опухолевых клеток и выживаемостью. Во-вторых, она подчеркивает, необходимость лекарственной терапии на самых ранних этапах развития заболевания. В-третьих, можно с уверенностью полагать, что промедление в лечении даже на короткий срок от нескольких недель до одного месяца может значительно изменить чувствительность опухоли к препаратам. Это предположение и было подтверждено клиническими наблюдениями за течением опухолевого процесса при раке молочной железы, когда отсрочка в лечении на месяц отрицательно повлияла на исход адъювантной химиотерапии. Эта теория объясняет также и неудачу химиотерапии там, где ожидали положительных результатов. Причина этого заключается в том, что, вероятно, общая масса микрометастазов превышает 109 клеток.
Многие механизмы стойкой специфической резистентности к доступным химиопрепаратам уже определены, и большинство из них базируется на генетической основе, что было продемонстрировано в экспериментах по переносу генов. Это положение проиллюстрировано в табл. 79-3. Внесем два необходимых уточнения. Политропная резистентность (резистентность ко множеству различных классов химиопрепаратов без предшествующего воздействия) была описана при раке грызунов и человека. Политропная резистентность порождает перекрестную резистентность к-большинству лучших и наиболее часто применяемых противоопухолевых средств, представляющих собой огромный арсенал веществ растительного происхождения и производных микроорганизмов. Нередко такая резистентность связана с появлением поверхностного гликопротеина с мол. массой 170000, причем его количество и определяет степень резистентности. Обнаружение этого гликопротеина может оказаться эффективным для выявления резистентных клеточных линий до начала химиотерапии. Представляется, что политропная резистентность может быть также вызвана недостаточным накоплением лекарственных веществ в связи с их быстрым выведением из организма. Известно, что многие препараты сами по себе не обладают противоопухолевой активностью, но при исследовании в экспериментальных системах потенцируют цитотоксический эффект некоторых химиотерапевтических средств (табл. 79-4). Антагонисты кальция, ингибиторы кальмодулина, полнённые антибиотики, аналоги трипаронала (Triparonal) и противоаритмические агенты обладают общим свойством хотя бы частично увеличивать локальное накопление противоопухолевых препаратов в резистентных опухолевых клетках. Поскольку политропная лекарственная резистентность во многом связана с уменьшением накопления противоопухолевых средств, вещества, увеличивающие уровень их содержания в клетках, привлекают внимание как потенциальные средства борьбы с первичной и политропной резистентностью, особенно у больных с рецидивом заболевания.
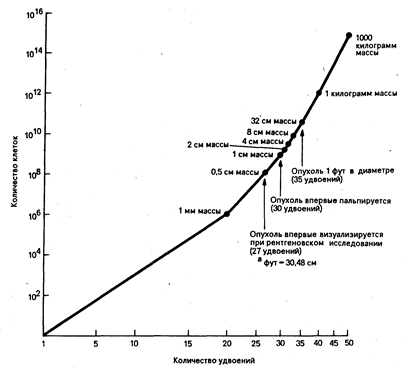
Рис. 79-3. Схематическое изображение жизненного цикла опухоли человека. Количество опухолевых клеток, имеющихся в организме, показано на оси ординат, количество удвоенной массы опухоли — на оси абсцисс. Клинические феномены, имеющие отношение к ожидаемому размеру массы опухоли,—на линии графика. К моменту постановки диагноза (1 см массы) большинство опухолей проходят по крайней мере 2/3 периода своего роста (32 удвоения).
Таблица 79-3. Механизмы резистентности к цитотоксическим препаратам
| Основной механизм | Препарат | Специфические нарушения | |
| Несовершенный транспорт | Метотрексат Мелфалан Эмбихин Цитарабин | Снижение промежуточного усвоения Снижение мембранных нуклео-зидных связывающих зон | |
| Нарушенный метаболизм активных форм | Цитарабин 5-Азацитидин 5-Фторурацил 6-Меркаптопурин \ 6-Тиогуанин ) Метотрексат Адриамицин | Снижение деоксицитидинкиназ-ной активности Снижение уридинцитидинкиназ-ной активности Снижение уридинкиназной активности, снижение уровней кислой фосфорибозилтрансфе-разы и уридинфосфорилазы Снижение HGPRT-активности Дефект полиглютамации Снижение Р450 или флавинре-дуктазы | |
| Увеличение лекарственной инактивации | 6-Меркаптопурин 6-Тиогуанин Цитарабин Алкилирующие вещества | Возрастание мембранной щелочной фосфотазы Возрастание цитидиндеаминаз-ной активности Возрастание внутриклеточного глутатиона или металлотионеина | |
| Нарушение репарации ДНК | Алкилирующие вещества Цисплатин Адриамицин | Возрастание эффективности удаления поврежденных оснований и/или связывание удаленных сегментов | |
| Амплификация генов с увеличением содержания белка-мишени | Кадмий N-фосфоацетиласпа-рагиновая кислота Метотрексат 5-Фторурацил Пентостатин | Увеличение количества копий гена металлотионеина Увеличение количества копий гена аспарагинотранскарбами-лазы Увеличение количества гена DHFR ? Увеличение количества копий гена тимидинситетазы ? Увеличение количества копий гена аденозиндеаминазы | |
| Повреждение мишеней | Метотрексат Винкристин 5-Фторурацил Гидроксимочевина Стероиды | Повреждение DHFP / Повреждение тубулина Повреждение тимидинсинтетазы Повреждение рибонуклеотидре-дуктазы Повреждение стероидного рецептора Повреждение стероидного рецеп-торного комплекса, блокирующего ДНК | |
| Повреждение нуклео-тидных пулов Восстановление путей | Цитарабин 5-Фтораурацил ) Метотрексат 5-Фторурацил | Увеличение внутриклеточных пулов СТР и dCTP Увеличение сохранности пурино-вых оснований Возрастание тимидинкиназной активности Л1\С | |
| Основной механизм | Препарат | Специфические нарушения | |
| Политропная лекарственная устойчивость | Адриамицин Винка-алкалоиды Дактиномицин Другие натуральные продукты | Несовершенная аккумуляция препарата, ведущая к возрастанию энергозависимой утечки ? Специфические мембранные гликопротеиновые маркеры | |
Таблица 79-4. Модуляция лекарственной устойчивости
| Препараты | Воздействующие противоопухолевые препараты | Предположительный механизм возрастающей цитотоксичности |
| Антагонисты ионов кальция | ||
| Верапамил | VCR, DNP, | Возрастающая аккумуляция за |
| Нифедипин | ADR | счет блока выведения |
| Нитрендипин (Nitrendipine) | ||
| Кароверин (Caroverine) | ||
| Ингибиторы кальмодулина | То же | |
| Дифрил | VCR, DNP | |
| Трифтазин | ADR | |
| Кломипрамил (Clomipramine) | ||
| Амфотерицин В | ADR, ACT-D BCNU | Нарушения в липидных комплексах плазматической мембраны, приводящие к возрастанию аккумуляции |
| Твин-80 | ADR | |
| Пергексилин малеат (Perhexi-line maleate) | ADR | |
| Аналоги трипаранола | ||
| Тамоксифен | ADR | Возрастание лекарственной аккумуляции |
| Антигипертензивные препараты | ADR | Возрастание лекарственной аккумуляции |
| Резерпин | ||
| Антиаритмические препараты Хинидин | ADR, VCR | Возрастание лекарственной ак |
| Кумуляции | ||
| Истощающие тиол | ||
| Бутионин сульфоксимип (Ви-thionine sulfoximine) | L-PAM, PLAT ADR | Инактивация препаратов, метаболизм свободных радикалов, защита/восстановление ДНК |
| 1 VCR — винкристин, DNP — даунорубицин, ADR — адриамицин, L-PAM — мелфалан, | ||
| PLAT—цисплатин, BCNU— 1,3бис(2-хлорэтил) 1-нитрозомочевина, ACT-D—актино- | ||
| мицин D. |
Итак, явление амплификации генов связано с лекарственной резистентностью. По-видимому, такая пластичность генома человека есть результат процесса редупликации и транскрипции при его замедлении или остановке, который может быть вызван веществами, угнетающими синтез ДНК, например, такими как алкилирующие агенты или облучение.
Таким образом, сильнодействующие противоопухолевые препараты и/или ионизирующее излучение могут вызвать развитие лекарственной устойчивости к таким препаратам, как метотрексат, еще до начала его применения, что следует учитывать при составлении программы лечения этими веществами.
Итак, стойкая специфическая лекарственная устойчивость носит спонтанный характер. Это явление следует изучать и ему можно противодействовать различными методами, такими как ранняя химиотерапия, иногда .до оперативного вмешательства (например, в случае возникновения рака в области головы и шеи, молочной железы), определение врожденной резистентности, применение более коротких и интенсивных курсов адъювантной химиотерапии для получения максимального эффекта с минимальным временем воздействия на выжившие клетки, так как длительный контакт таких клеток с противоопухолевым агентом может повысить уровень их мутации.
Средства, влияющие на дифференцировку клеток. Возрастает число заслуживающих внимания сообщений о том, что при некоторых злокачественных процессах, таких как лейкозы, происходит задержка дифференцировки клеток. Некоторые препараты, например, производные гексаметилбисацетамида, ретиноиды и биологические средства (интерферон) могут влиять на процессы дифференцировки лейкозных клеток in vitro, вызывая их созревание. В единичных сообщениях показана способность ретиноида 13-цис-ретиноевой кислоты вызывать некоторое усиление дифференцировки при остром миелолейкозе у человека.
Создано два лекарственных средства—диметилформамид (Dimethylformamide) и гексаметилбисацетамид (Hexamethylbisacetamide), обладающие более выраженным свойством повышать уровень дифференцировки опухолевых клеток, нежели цитотоксическим эффектом. Эти средства проходят клинические испытания.
Эндокринная терапия. Чувствительностью к гормональному воздействию обладают опухоли предстательной железы, эндометрия или лимфоидной ткани. Механизмы взаимодействия гормонов и их рецепторов тщательно изучены. Гормоны связываются рецепторами цитоплазмы и ядра, меняя пространственную конфигурацию самого рецепторного белка, взаимодействующего с ДНК и отвечающего за активацию специфической транспортной РНК и синтез белка. Вследствие этого взаимодействия содержание рецепторов в цитоплазме восстанавливается и цикл может повторяться. Кортикостероиды надпочечников уникальны по сравнению с другими стероидными гормонами, так как оказывают небольшой противоопухолевый эффект на ткани, в норме не принадлежащие к эндокринным органам, например на клеточные элементы при остром лейкозе. В цитоплазме лейкозных клеток были найдены рецепторы к кортикостероидам, что само по себе (вне связи с другими неспецифическими эффектами кортикостероидов) может объяснять их противоопухолевое действие. Кроме того, в этих же клетках обнаружены, рецепторы к прогестеронам и андрогенам.
Наиболее хорошо изучена корреляция между количеством гормонсвязывающих белков цитоплазмы опухолевых клеток и ответом на гормональную терапию при раке молочной железы, хотя и при раке предстательной железы и тела матки в цитоплазме опухолевых клеток также обнаружены белки, связывающие соответствующие гормоны. Несмотря на то что гормоны эффективны сами по себе, они все более и более используются совместно с другими лечебными средствами как для синхронизации клеточного цикла, так и для повышения уязвимости .опухолевых клеток к цитотоксическим препаратам (в случае рака молочной железы) или в качестве нетоксичного компонента при проведении комбинированной лекарственной терапии (лейкозы, лимфомы, рак молочной и предстательной железы).
Агонисты гипоталамических нейропептидов нашли применение в качестве регуляторов, воздействующих на рецепторы гормонально-зависимых тканей. Этот новый подход к гормональной блокаде иногда комбинируется с применением антагонистов гормонов. Последнее позволило получить клинически выраженный быстрый эффект при лечении рака предстательной железы и избежать кардиоваскулярной токсичности от применения эстрогенов.
Биологические средства и терапия рака. С момента открытия роли иммунной системы в контроле над развитием злокачественных процессов иммунологические подходы к лечению опухолей находились вне зоны исследований более двух десятилетий. Обработка уникальной комплексной информации о функции иммунной системы внушает определенные надежды относительно развития направления по использованию иммунных процессов как специфической интегральной части в систематизированных разработках терапии рака. С развитием гибридомной техники с 1975 г. получено большое количество моноклональных антител к опухолеассоциированным антигенам при раке толстой кишки, легких, поджелудочной железы, меланоме, лейкозах и лимфомах. Необходимы дальнейшие клинические испытания для выяснения роли этих антител в качестве самостоятельных лечебных агентов или связанных с токсинами (например, с токсином Pseudomonas) или с радиоизотопами, особенно с -излучением.
Более ранние клинические исследования показали, что моноклональные антитела могут вызывать временные регрессии лейкозов и лимфом. С развитием техники по созданию рекомбинантных ДНК стало возможным клонирование генов, ответственных за выработку высокоактивных лимфокинов, и получение высокоочищенных биологически активных веществ в количествах, достаточных для клинических испытаний, в то время как ранее они были доступны лишь в минимальных количествах. Это фактор роста Т-лимфоцитов (интерлейкин-2), опухоль-некротизирующий фактор и интерферон. В экспериментальных системах биологические факторы наиболее эффективны при небольших объемах опухолевых клеток, и поэтому их применение после хирургического вмешательства, облучения или во время ремиссии, вызванной химиопрепаратами, окажется важным направлением в дальнейших клинических исследованиях.
Противоопухолевые препараты являются иммунодепрессантами, и поэтому применение биологически активных веществ, вызывающих нормализацию иммунного статуса, в подобной ситуации было бы целесообразным. Очищенный интерлейкин-2 (ИЛ-2) может использоваться в качестве средства, способного восстанавливать и увеличивать популяцию лимфоцитов, относящихся к лимфокинин-активированным клеткам (ЛАК-клетки), отличающихся от нормальных клеток-киллеров значительно более выраженной способностью к уничтожению аутологичных опухолевых клеток как у грызунов, так и у человека вне зависимости от их иммунной принадлежности. Совместное применение ИЛ-2 и ЛАК-клеток позволило получить положительный результат (выздоровление животных) в экспериментах на грызунах с метастазирующими опухолями.
В процессе изучения действия указанных средств у человека удалось получить полную или частичную ремиссию при назначении больших доз препаратов больным с распространенными формами меланомы с метастазами, опухолями толстой кишки, легких и почек. Эти эксперименты позволяют надеяться на то, что ИЛ-2 и ЛАК-клетки явятся новыми формами биологических средств в терапии рака на ранних стадиях заболевания.
В ряде случаев положительный эффект оказывает местная неспецифическая иммунотерапия, в основе которой лежит феномен реакции гиперчувствительности замедленного типа в зоне расположения опухоли на коже. Инъекции вакцины Кальметта — Герена (БЦЖ) в зоны подкожных рецидивов при раке молочной железы или меланоме являются неплохим, хотя и редко используемым методом лечения местных рецидивов. Феномен замедленной гиперчувствительности может быть вызван и кожными аппликациями динитрохлорбензена (Dinitrochlorobenzene). При поверхностном плоскоклеточном раке и базалиоме кожи многократные аппликации динитрохлорбензена дают такую же степень излеченности, как и местное применение 5-фторурацила.
У грызунов важную роль сенсорных клеток в модуляции иммунного ответа на воздействие опухолевых антигенов играют макрофаги. Успехи в изучении способов активации системы макрофагов связывают с левамизином, препаратом для лечения протозойных инфекций. Он усиливает подавленную функцию лимфоцитов за счет стимуляции макрофагов и, связанный с 5-фторурацилом, значительно снижает частоту возникновения рецидивов и повышает выживаемость при адъювантной химиотерапии рака толстой кишки.
Влияние массы опухоли на излечимость заболевания и величину тест-дозы.Скорость роста опухоли и ее размер обычно измеряются в виде логарифмической величины. Например, у человека может быть клинически выявлена опухоль при ее размере около 1 см, к этому времени опухоль содержит примерно 1 биллион клеток. В то же время для некоторых форм злокачественных новообразований количество опухолевых клеток 1012 может уже приводить больного к смерти (летальная масса). Масса опухоли — важнейшая переменная величина, учитываемая при всех модификациях противоопухолевой терапии.
Хирургическое лечение. Масса первичной опухоли находится в прямой зависимости от степени местной инвазии, а степень инвазии является довольно жестким показателем вероятности наличия отдаленных метастазов при большинстве злокачественных новообразований, особенно при раке толстой кишки, молочной железы и меланоме. В пределах данной гистологической формы опухоли ее масса — важнейший фактор излечимости процесса при хирургическом методе лечения.
Тест-доза и лучевое лечение. Для клинических нужд лучевой терапии кривая дозовой чувствительности данной формы опухоли может быть построена как функция дозы; чем больше масса опухоли, тем меньше вероятность устранения ее без значительного повреждающего действия на окружающие ткани. Кривая дозовой чувствительности лучевого воздействия представлена на рис. 79-4. Фракция выживающих клеток находится на логарифмической шкале против дозы облучения. Наклон экспоненциальной части кривой — средняя летальная доза — обычно обозначается До и является стандартным ориентиром. До — условная доза, необходимая для того, чтобы вызвать начало гибели клеток любой биологической системы. Чем выше радиочувствительность клетки, тем круче кривая. Из-за случайного распределения лучевой энергии часть ее будет расходоваться на уже разрушенные клетки, часть пропадет вовсе. Согласно правилу Poisson распределения лучевой энергии, вместо ожидаемого разрушения всех клеток До уничтожит только 63% из них. Доза, которую необходимо подвести к очагу Для того, чтобы дополнительно разрушить 37% оставшихся клеток, называется Д37 и считается индексом радиочувствительности. Для большинства клеток значения индекса радиочувствительности лежат в диапазоне 0,80—2 Гр (80—200 рад). Фракция выживающих клеток после двух средних летальных доз составит 37% от исходных 37, т. е. 13,7%, а после трех — 5,1% и т. д. На практике логарифмическая кривая не является строго прямой линией: прежде чем кривая станет экспоненциальной, ей предшествует линия подъема. Для строго экспоненциальной линии Д0=Д37. Линия подъема отражает те дозы, при которых клетки могут восстанавливаться от лучевых повреждений. Доза, при которой кривая становится экспоненциальной, является пороговой (Дq). Восстановление лучевых повреждений возможно в течение 2 ч после облучения. Идентификация восстановительного периода для Дq, Д0 и Д37 и механизмы репаративных процессов являются важнейшими клиническими аспектами для разработки методов фракционного облучения и комбинированного лучевого воздействия в сочетании с лекарственными средствами.
Дозовая чувствительность (тест-доза) и химиотерапия. Химиотерапия впервые была предложена как резервное средство для лечения распространенного опухолевого процесса, когда хирургическое вмешательство и облучение уже исчерпали свои возможности. В большинстве случаев химиотерапия может уменьшить количество опухолевых клеток от 2 до 3 логарифмов и вызывает лишь небольшое паллиативное действие даже у больных с количеством опухолевых клеток 10 ^.Следует учитывать и тот факт, что почти все химиопрепараты действуют на клетки опухоли, находящиеся либо в фазе роста, либо деления, тогда как многие клетки находятся вне этих состояний и поэтому не являются мишенями для воздействия большинства лекарственных средств. При распространенных метастатических поражениях тщательного уничтожения опухолевых клеток добиться невозможно даже в случаях лекарственно-чувствительных злокачественных новообразований.
Цитотоксическое действие противоопухолевых препаратов подчинено строгому правилу: они разрушают не столько определенное число опухолевых клеток, сколько определенную фракцию. Курс химиотерапии, ведущий к уничтожению 103 опухолевых клеток, уменьшит массу опухоли с 1010 до 107 или с 105 до 102. Большинство известных противоопухолевых препаратов (применяемых в качестве монотерапии) обладают ограниченной противоопухолевой активностью. Смысл фракционного цитотоксического действия заключается в том, чтобы эффективно уничтожить популяцию опухолевых клеток, чувствительных к химиопрепарату. Это необходимо учитывать при увеличении доз в случае низкой толерантности организма больного к действию препарата или при лечении новообразования с небольшим количеством чувствительных клеток в дозах, безвредных для нормальных органов и тканей. По сравнению с нормальными опухолевые клетки являются более чувствительными к цитотоксическому действию противоопухолевых средств. Клинические исследования, дополняемые экспериментами, проводимыми на животных, показывают, что при достаточной степени различия цитотоксического действия лекарственных веществ на опухолевые и нормальные клетки можно избежать побочного воздействия препаратов на костный мозг, желудочно-кишечный тракт, нередко наблюдаемого даже у лиц с лекарственно-чувствительными формами новообразований.
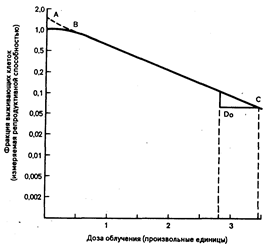
Рис. 79-4. Кривая дозовой чувствительности лучевого воздействия (см. текст).
По реакции на химиопрепараты опухолевые клетки условно можно подразделить на три класса (см. рис. 79-2). Первый класс— это клетки с активным ростом, они наиболее чувствительны к воздействию химиотерапии. Второй — популяция клеток, в данный момент не делящаяся, но способная к делению, т. е. находящаяся в фазе G1 и G0 клеточного цикла. Эта популяция менее чувствительна, чем первая, к противоопухолевым средствам, особенно к влияющим на клеточное размножение метаболитам. Вместе с тем следует помнить, что этот тип резистентности нередко носит временный характер. И, наконец, третий класс клеток, неспособных к делению, но являющихся неотъемлемой частью массы опухоли вплоть до своей гибели. Кривые тест-дозы токсичности и терапевтического эффекта при раке по форме являются крутыми. В ходе некоторых экспериментов на грызунах снижение дозы на 20% вело к уменьшению лечебного эффекта на 50%. Эти данные получены в результате изучения действия дозировки препарата при составлении эффективной комбинации лекарственных средств. В большинстве вариантов комбинаций эффективных химиопрепаратов, составленных с целью уменьшить токсическое воздействие каждого из них, наблюдается также и уменьшение лечебного воздействия. Дозовый эффект химиотерапии требует введения необходимого количества препарата в течение определенного отрезка времени. Так как большинство химиотерапевтических средств оказывает токсическое действие на делящиеся клетки, между курсами должны соблюдаться интервалы, достаточные для восстановления популяции клеток нормальных органов и тканей. Чаще всего это касается клеток костного мозга, для обновления которых у человека необходимо от 18 до 28 дней. Продолжительные перерывы между курсами химиотерапии, даже если препараты вводятся в полной дозе, уменьшают дозовый эффект регрессии опухоли и могут вызвать развитие постоянной лекарственной устойчивости. Это было доказано на экспериментальных моделях и в условиях клинической практики в случаях острого миелолейкоза, болезни Ходжкина и мелкоклеточного рака легкого.
С тех пор как эффект воздействия большинства программ лекарственного лечения регистрируется на основе определенного уровня фиксированной дозы, желательно уменьшить ad hoc повреждения при использовании специфических режимов введения лекарственных средств в клинике с целью успешного применения во всех типичных случаях эффективной лечебной программы.
Дата добавления: 2015-03-17; просмотров: 1566;
