Биология опухолевого роста
Основы противоопухолевой терапии базируются на наших знаниях о биологии опухолевого роста. Два десятилетия назад представление о том, что даже небольшие по размерам первичные раковые опухоли отторгают жизнеспособные опухолевые клетки в систему циркуляции и эти клетки способны расти так же, как и в первичной опухоли, основательно изменили представления о вероятности полного излечения рака путем применения лишь методом локального контроля первичного очага, что и привело к развитию системных методов воздействия, таких как химиотерапия и биологические методы лечения. Оказалось, что раковый фенотип возникает в результате нарушений в генетических механизмах, имеющих значение для биологии развития. В нормальном геноме существует группа генов, сохраняемых с высоким постоянством. Имеются сведения о том, что нарушение их структуры или изменение локализации в пределах генома являются ответственными за нарушение регуляции роста вследствие продукции несвойственных норме протеинов или необычных их количеств. Хотя протоонкогены были первоначально выявлены в несовершенных онкогенных ретровирусах, существование протоонкогенов в нормальных тканях и онкогенов во многих раковых опухолях человека было доказано в опытах с переносом ДНК (см. гл. 59). Возрастание или нарушение экспрессии было обнаружено в мелкоклеточном раке легкого, раке толстой кишки и молочной железы, лимфомах. Злокачественный фенотип более всего похож на конечный результат экспрессии каскада этих генов. Тот факт, что продукты этих генов являются важными для роста клеток, подчеркивается частичным их соответствием некоторым факторам роста и их рецепторам. Опыты на мышах, подвергнутых генной мутации (мыши вводились одиночные копии онкогенов путем вставки в оплодотворенную яйцеклетку), обеспечили открытие важного пути для выявления каскада генов, активированных для каждого гистологического типа рака, и применимы для контроля экспрессии этих генов как будущих средств предупреждения, диагностики или лечения рака у человека. Например, показано, что фосфорсодержащие производные нуклеозидов, комплементарные ДНК известных онкогенов, которые могут пенетрировать клеточные мембраны, способны блокировать трансляцию м-РНК и препятствовать функционированию этих генов in vitro.
Так как протоонкогены — это важные элементы в регуляции эмбрионального роста, то неудивительно, что расстройства регуляции могут привести к неконтролируемому патологическому росту. Для опухолевых клеток характерны не только неконтролируемый рост, но и способность к миграции и метастазированию в жизненно важные органы с замещением их ткани. Некоторые группы клеток клонируют гены, ответственные за регуляцию способности к метастазированию. Это дает основание предположить, что, подобно механизмам регуляции роста, способность к метастазированию является нарушением генетических механизмов, ответственных за миграцию нормальных .клеток. Свойство метастазировать, вероятно, связано со способностью злокачественных клеток экспрессировать рецепторы к белку базальной мембраны — ламинину и таким ферментам, как коллагеназы (необходимым для фиксации клеток к базальной мембране и ее разрушения), тем самым создавая возможность для удаления клетки от места ее первоначальной локализации. В исследованиях на человеке было показано, что клетки рака молочной железы экспрессируют огромное количество рецепторов к ламинину. При этом имеется прямая зависимость между экспрессией рецепторов и метастазированием в подмышечные лимфатические узлы. Развитие способности к метастазированию, возможно, является относительно поздней ступенью в цепи генетических нарушений, приводящих к развернутой клинической картине опухолевого процесса. Этот факт следует учитывать, анализируя появление поздних отдаленных метастазов при опухолях больших размеров определенного гистологического строения. Воздействие на способность раковых клеток к миграции имеет терапевтическое значение. Блокирование рецепторов ламинина фрагментами молекулы ламинина in vitro уменьшает способность клеток к метастазированию in vivo.
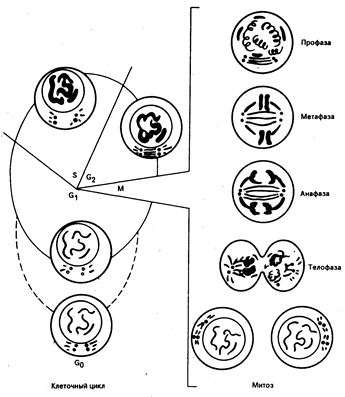
Рис. 79-1. Клеточный цикл.
Терминология определенных периодов клеточного цикла включает следующие фазы — М, G1, S и G2. М — период клеточного деления; g1 — период нормального клеточного метаболизма, но при отсутствии синтеза репликации ДНК; клетки, которые в течение длительного времени остаются в G1-фазе, часто расцениваются как элементы, находящиеся в G0-фазе; S-фаза, или фаза синтеза ДНК,— период редупликации ДНК; за ней следует G2-фаза, или тетраплоидная фаза, которая предшествует делению клетки. Нормальные и раковые клетки характеризуются сходными временными циклами, обычно М-фаза — 0,5—1 ч, g1 — от 2 ч до бесконечности, S — от 6 до 24 ч, G2 — от 2 до 8 ч.
При малигнизации клеток кинетика их роста легко определима и сходна с таковой у клеточных элементов нормальных тканей. В зависимости от особенностей роста нормальные ткани подразделяются на три основных класса: возобновляющиеся (герминативные клетки и клетки костного мозга), развивающиеся (печень, почки, эндокринные железы) и статические (нейроны и поперечно-полосатые мышечные волокна). В статических тканевых системах (например, нейроны) клетки живут в течение жизни целостного организма и не восстанавливаются в случае их разрушения. В восстанавливающихся тканях клетки приобретают очевидную способность к делению только после уменьшения клеточной массы (вследствие травмы или хирургического вмешательства), и объем ткани восстанавливается. Взрослые клетки возобновляющихся тканей имеют определенный, обычно короткий жизненный цикл и замещаются за счет пула стволовых клеток. До тех пор пока интенсивность размножения клеток не начинает доминировать над процессом их гибели, неопластические процессы не обнаруживают себя (заметим, что и клетки нормального костного мозга способны к «метастазированию», расселяясь за его пределы). Вне зависимости от тканевого источника злокачественного роста кинетика растущей популяции опухолевых клеток аналогична таковой в возобновляющихся нормальных тканях. Особенности развивающейся опухоли лучше всего отражены как функция Compertzian. При увеличении клеточной массы рост опухоли соизмерим с экспоненциальным отставанием роста. Время удвоения опухоли (время, за которое происходит увеличение массы опухоли вдвое) — сложная величина, зависящая от времени клеточного цикла, количества в популяции клеток в фазе деления и гибнущих клеточных форм. Фазы клеточного цикла деления представлены на рис. 79-1. Жизнеспособные клетки, не участвующие в цикле, но способные при определенных условиях к делению, находятся в так называемой-фазе покоя (G0). Часть клеток данной популяции, находящихся в цикле клеточного деления (пролиферативный пул, фракция роста), можно выявить подключению 3Н-тимидина в ДНК (индекс метки), четко отражающему скорость роста опухоли. Несмотря на то что скорость роста опухоли для данного гистологического типа является относительно постоянной величиной, существуют значительные различия во времени клеточного цикла опухолевой ткани и ее нормального тканевого аналога. При одинаковой продолжительности клеточного цикла быстрее удвоится опухоль с более высоким показателем пролиферативного пула в случае одинакового количества гибнущих и метастазирующих клеток (потеря клеток). Именно большей потерей клеток можно объяснить длительный период удвоения массы опухоли при высоких показателях пролиферативного пула (фракции роста). Потеря клеток начинается на ранних этапах роста опухоли. Даже маленькие (размером 1—2 мм) хорошо отграниченные опухоли теряют клетки вследствие их проникновения в окружающие ткани (например, опухоль толстой кишки теряет клетки со своей поверхности в просвет органа), лимфу или кровь. Потеря клеток может быть связана с их миграцией вследствие активного метастазирования или неспособностью клеток к образованию жизнеспособных колоний. Тот факт, что некоторые злокачественные опухоли поддаются местному лечению, подтверждает предположение о том, что многие клетки, отторгнутые от первичной опухоли, по разным причинам не могут образовать метастатические очаги. Одной из таких причин может быть отсутствие расстройств регуляции генов, ответственных за клеточную миграцию.
Клональное развитие рака. Концепция развития опухоли из единственной трансформированной клетки или клона основывается на цитогенетических исследованиях новообразований человека. Классическим примером клонального происхождения опухоли является множественная миелома, представленная опухолевыми плазматическими клетками, секретирующими в большом количестве один и тот же тип молекулы глобулина, обнаруживаемый в крови или моче. Специфические нарушения структуры хромосом выявлены более чем в 95% всех опухолей. Первой была описана филадельфийская хромосома, встречающаяся почти у 95% больных хроническим миелолейкозом (ХМЛ) (гл. 289). В некоторых случаях аномальная хромосома 22 обнаруживается в кроветворных клетках-предшественниках за несколько лет до клинического проявления лейкоза. Клональное происхождение этого заболевания в дальнейшем подтвердилось изучением Х-инактивированной мозаичности. Каждая клетка женщины детерминирована на ранних стадиях эмбриогенеза и не зависит от активации или супрессии отцовской или материнской Х-хромосомы. С Х-хромосомой связан фермент глюкозо-6-фосфат-дегидрогеназа (Г-6-ФД), оказавшийся хорошим маркером для изучения клонального происхождения опухолей благодаря своему полиморфизму в популяции чернокожего населения. Женщины, гетерозиготные по локусу Г-6-ФД для общего гена GdA и вариантного GdА имеют две различные популяции клеток, что отражается на картине электрофореза. В то время как в лейкоцитах женщин, гетерозиготных по Г-6-ФД и не страдающих лейкозом, определяют оба (А и В) типа фермента. У пациентов с хроническим миелолейкозом в опухолевых гранулоцитах обнаруживается только один тип фермента, что предполагает развитие болезни из одного клона клеток. Для некоторых онкогенов были обнаружены места расположения в зонах транслокаций, например на хромосомах 9 (с-abl) и 22 (c-sis) при хроническом миелолейкозе и хромосоме 14 (c-myc) при лимфоме Беркитта. В последнем случае продукт гена C-myc не изменен, но экспрессирован весьма существенно, так как подчинен контролю последовательности промотора гена иммуноглобулина тяжелых цепей на хромосоме 14. Показано, что цитогенетические нарушения при таких злокачественных заболеваниях, как острый миелолейкоз, могут служить показателем чувствительности заболевания к лечению и, по-видимому, типичны для определенного типа клеток. У больных с рецидивами после стойкой ремиссии, достигнутой в результате химиотерапии, обычно появляются исходные цитогенетические нарушения, которые вместе с тем могут быть связаны и с дополнительными транслокациями. При исследовании генов, регулирующих синтез глобулинов, обнаружено биклональное происхождение фолликулярных лимфом. При нейрофиброме и трихоэпителиоме, являющихся наследственными опухолями, обнаружено два энзимных фенотипа, что указывает на поликлональный генез этих новообразований. Эти исключения предполагают, что теория соматической мутации онкогенеза не может быть единственной для объяснения возникновения всех видов новообразований.
Дата добавления: 2015-03-17; просмотров: 1417;
