Индивидуализация лекарственной терапии
Для успешного проведения лечения очень важно знать факторы, модифицирующие действие того или иного лекарственного средства, поскольку это в значительной степени может обеспечить максимальную пользу и минимальный риск для каждого больного.
Изменение дозы лекарственного средства при заболеваниях почек. Если основным путем выведения лекарственного средства из организма является экскреция с мочой, то почечная недостаточность может приводить к уменьшению его клиренса и, следовательно, к замедлению выведения из организма. В таких случаях введение обычной дозы препарата приведет к большему накоплению его и повышенной вероятности токсических реакций. Для предотвращения этого следует так изменить дозировку, чтобы средняя концентрация лекарственного средства в плазме крови больного, страдающего почечной недостаточностью, была такой же, как у больного с нормальной функцией почек, а устойчивое состояние наступало примерно через такой же промежуток времени. Это особенно важно в случае применения лекарственных средств, обладающих большим периодом полувыведения и узким диапазоном терапевтических доз (например, дигоксина).
Один из подходов состоит в том, чтобы вычислить долю нормальной дозы, которую следует вводить с обычным междозовым интервалом. Величину этой доли можно определить исходя или из клиренса данного лекарственного средства (Сl), или из константы (k) скорости выведения доли его дозы, основываясь на том, что и почечный клиренс, и величина k пропорциональны клиренсу креатинина (Сlкр). Клиренс креатинина лучше всего определять непосредственно, однако можно использовать и показатель содержания креатинина в сыворотке крови (Скр). Определяют величину клиренса с помощью следующего уравнения (для мужчин):
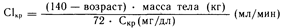
При расчете величины клиренса для женщин, полученную с помощью этого уравнения, величину следует умножить на 0,85. Такой способ расчета величины С1кр не пригоден для больных, страдающих тяжелой почечной недостаточностью (Скр> 5 мг/дл), или в случае быстро изменяющейся функции почек.
Расчет дозы исходя из величины клиренса. Расчет дозы лекарственного средства точнее всего производится на основе известного клиренса этого вещества. По имеющимся данным о клиренсе какого-либо лекарственного средства его дозу при почечной недостаточности (Дозапн) можно вычислить из следующего соотношения:
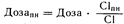
С1 = С1почечный + С1непочечный; где пн — почечная недостаточность,
Доза — поддерживающая доза при нормальной функции почек
(Clкp прибл. равно 100 мл/мин),
Сl — клиренс из всего организма при нормальной функции почек, Сlпн — клиренс из всего организма при почечной недостаточности. Величины клиренса в норме и клиренса при почечной недостаточности можно определить, используя приведенные в табл. 64-1 данные, из следующих соотношений:
Таблица 64-1. Клиренс лекарственных средств
| Лекарственное средство | Почечный клиренс' | Непочечный клиренс (мл/мин) |
| Ампициллин' | ||
| Карбенициллин | ||
| Дигоксин2 | ||
| Гентамицин | ||
| Канамицин | ||
| Пенициллин3 |
Нормальные значения почечного клиренса — это не значения, которые соответствуют клиревсу креатинина, равному 100 мл/мин.
Доля дигоксина, абсорбируемая после его перорального введения, (F) равна приблизительно 0,75, а F ампициллина — 0,5. Один микрограмм пенициллина G=1,6ЕД.
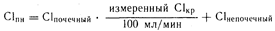
Значения Сlпочечный, приведенные в табл. 64-1, определены при Сlкр=100 мл/мин, а значения почечного клиренса лекарственного средства при почечной недостаточности получены путем умножения Сlпочечный на частное от деления измеренного Сlкр (в мл/мин) на 100 мл/мин.
Для гентамицина в норме при значениях Сlпочечный 78 мл/мин и Сlнепочечный 3 мл/мин общий клиренс (Сl) равен 81 мл/мин. Следовательно, при Сlкр 12 мл/мин, Сlпн = 78 • (12/100) + 3 = 12,4 мл/мин. Если доза гентамицина сульфата в случае какого-либо заболевания при сохранной нормальной функции почек равна 1,5 мг/кг за 8 ч, то
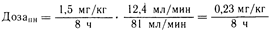
Для больного с почечной недостаточностью эта расчетная доза будет обеспечивать такой же средний уровень содержания лекарственного средства в плазме крови в течение междозового интервала, как и при нормальной функции почек; однако разница в величинах концентраций между их пиковыми и нижними значениями будет менее выраженной.
В некоторых случаях желательно вычислить такую величину дозы, которая обеспечивала бы определенный уровень содержания лекарственного средства в плазме крови при устойчивом состоянии. Такой подход наиболее целесообразен в случае непрерывного внутривенного вливания лекарственного средства, при котором 100% вводимой дозы попадают в систему кровообращения. После того как клиренс данного лекарственного средства у больного с почечной недостаточностью будет рассчитан приведенным выше способом, необходимая доза определится из соотношения:
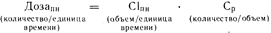 где время, количество лекарственного средства и объем представлены в однородных единицах измерения:
где время, количество лекарственного средства и объем представлены в однородных единицах измерения:
Если поставленной при лечении задачей является поддержание у больного, обладающего клиренсом креатинина, равным 25 мл/мин, концентрации карбенициллина динатриевой соли в плазме крови на уровне 100 мкг/мл, то скорость введения (на основе данных табл. 64-1) рассчитывается следующим образом:
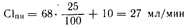
Таблица 64-2. Вычисленные значения доли обычной дозы лекарственного средства, необходимой для больного с клиренсом креатинина, равным 0 (долевая доза0), и средние значения константы суммарной долевой скорости выведения для больного с нормальной функцией почек (k)
| Лекарственное средство | Долевая дозао | k, в час |
| Антибиотики и сульфаниламидные препараты | ||
| Амикацин | 0,01 | 0,4 |
| Амоксициллин (Amoxicillin) | 0,15 | 0,7 |
| Ампициллина натриевая соль | 0,1 | 0,6 |
| Карбенициллина динатриевая соль | 0,1 | 0,6 |
| Цефалексин | 0,04 | 0,7 |
| Цефалоридин | 0,08 | 0,4 |
| Цафалотин (Cephalothin) | 0,02 | 1,4 |
| Цефазолин | 0,06 | 0,35 |
| Левомицетин | 0,8 | 0,3 |
| Клиндамицин (Clindamycin) | 0,8 | 0,2 |
| Клоксациллин (Cloxacillin) | 0,25 | 1,2 |
| Колистиметат (Colistimethate) | 0,3 | 0,2 |
| Диклоксациллина натриевая соль | 0,5 | 1,2 |
| Доксициклина гидрохлорид | 0,8 | 0,03 |
| Эритромицин | 0,7 | 0,5 |
| Гентамицина сульфат | 0,02 | 0,3 |
| Изониазид: | ||
| Быстрые инактиваторы | 0,8 | 0,5 |
| Медленные инактиваторы | 0,5 | 0,25 |
| Канамицин | 0,03 | 0,35 |
| Линкомицина гидрохлорид | 0,4 | 0,15 |
| Метициллина натриевая соль | 0,12 | 1,4 |
| Миноциклин (Minocycline) | 0,9 | 0,06 |
| Нафциллин (Nafcillin) | 0,4 | 1,2 |
| Оксациллина натриевая соль | 0,25 | 1,4 |
| Окситетрациклин | 0,2 | 0,08 |
| Пенициллин G | 0,1 . | • 1,4 |
| Полимиксина В сульфат | 0,12 | 0,15 |
| Рифампицин | 1,0 | 0,25 |
| Стрептомицина сульфат | 0,04 | 0,25 |
| Сульфазин | 0,45 | 0,7 |
| Сульфаметоксазол | 0,85 | 0,07 |
| Тетрациклин | 0,12 | 0,08 |
| Тобрамицин | 0,02 | 0,35 |
| Трикарциллин (Tricarcillin) | 0,1 | 0,6 |
| Триметоприм | 0,45 | 0,06 |
| Ванкомицин (Vancomycin) | 0,03 | 0,12 |
| Разные лекарственные средства | ||
| Хлорпропамид | 0,4 | 0,02 |
| Лидокаин | 0,9 | 0,4 |
| Антуран | 0,55 | 0,3 |
| Сердечные гликозиды | k, в сутки | |
| Дигитоксин | 0,7 | 0,1 |
| Дигоксин | 0,3 | 0,45 |
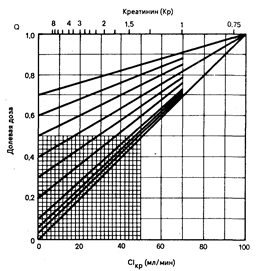
Рис. 64-4. Номограмма для определения величины долевой дозы у страдающих почечной недостаточностью больных (способ пользования номограммой описан в тексте).
Следовательно, карбенициллина динатриевую соль следует вводить со скоростью 2700 мкг/мин.
Если метод расчета дозы, основанный на достижении желательного уровня содержания лекарственного средства в плазме крови, будет применен при интермиттирующем его введении, то особое внимание следует уделить тому, что этот расчет базируется на среднем уровне содержания лекарственного средства в плазме и пиковые уровни его содержания будут выше. Кроме того, если вводимое перорально лекарственное средство не полностью абсорбируется, то полученную расчетом дозу следует разделить на значение доли (F), попадающей в систему кровообращения (см. выше).
Расчет дозы исходя из величины константы долевой скорости выведения (k). Для многих лекарственных средств отсутствуют данные об их клиренсе при почечной недостаточности. В этих случаях долю нормальной дозы, необходимую для такого больного, можно приблизительно рассчитать, основываясь на величине отношения константы долевой скорости выведения из организма при почечной недостаточности (kпн) к аналогичной константе при нормальной функции почек (k). Такой подход предполагает, что заболевание почек не влияет на распределение лекарственного средства (Vd), и его доза может быть рассчитана исходя из величины клиренса:
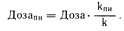
Поскольку отношение kпн/k представляет собой долю обычной дозы, применяемой при данной степени тяжести почечной недостаточности, его называют долевой дозой; определяется оно на основе данных, приведенных в табл. 64-2, и на соответствующей номограмме (рис. 64-4). В табл. 64-2 приведены значения доли обычной дозы лекарственного средства, требуемой при клиренсе креатинина, равном 0 (долевая дозао). На номограмме долевая доза представлена в виде функции клиренса креатинина.
Для расчета долевой дозыпн в табл. 64-2 находят соответствующую величину долевой дозы0, наносят ее значение на левую ось ординат номограммы, приведенной на рис. 64-4, и соединяют эту точку прямой линией с правым верхним углом номограммы. Полученная линия показывает величину долевой дозы в диапазоне значений клиренса креатинина от 0 до 100 мл/мин. Точка пересечения перпендикуляра, восстановленного из точки измененного клиренса креатинина (на оси абсцисс), и линии долевой дозы представляет собой координату величины долевой дозы (на оси ординат), соответствующей этому конкретному значению клиренса креатинина. Например, если больному, обладающему клиренсом креатинина, равным 20 мл/мин, требуется введение пенициллина G для лечения инфекции, которая у больного с нормальной функцией почек лечится введением 10000000 ЕД в сутки, то соответствующая доза будет равна 2800000 ЕД в сутки. Эта доза получается путем нанесения на ось ординат величины долевой дозы0 пенициллина G (0,1) и соединения ее прямой линией с верхним правым углом номограммы (см. рис. 64-4). На этой линии долевой дозы для пенициллина G координата для величины клиренса креатинина, равной 20 мл/мин, соответствует величине долевой дозы, равной 0,28 на оси ординат. Следовательно, требуемая доза будет равна 0,28•10000000 ЕД в сутки.
Нагрузочная доза. В дополнение к корректировке поддерживающей дозы при почечной недостаточности необходимо уделить внимание также нагрузочной дозе. Поскольку эта доза предназначена для быстрого доведения концентрации лекарственного средства в плазме крови или, в особенности, уровня его содержания в организме до уровней, соответствующих устойчивому состоянию, нет необходимости изменять обычную нагрузочную дозу, если ее применяют в норме. Выведение многих лекарственных средств происходит достаточно быстро, так что время, необходимое для достижения устойчивого состояния, невелико, и не возникает необходимости применять нагрузочную дозу. С другой стороны, при почечной недостаточности, когда период полувыведения может значительно увеличиться, период накопления может стать недопустимо длительным. В таком случае нагрузочную дозу можно вычислить приведенным выше способом (см. подраздел «Накопление лекарственного средства») применительно к дробному введению лекарственного средства. Примерную величину нагрузочной дозы для непрерывного введения можно определить (когда все единицы согласуются между собой) следующим образом:
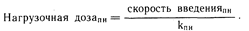
Общие соображения относительно определения величины дозы при почечной недостаточности. Вследствие различий в объемах распределения и скорости метаболизма вычисленные значения доз лекарственных средств при почечной недостаточности представляют определенную ценность как позволяющие предотвратить использование завышенных или заниженных доз лекарственных препаратов для большинства больных. Однако наиболее адекватными величины поддерживающих доз будут в том случае, если при необходимости корректировки дозы учитываются действительные уровни содержания лекарственного средства в плазме крови.
При выполнении всех приведенных выше расчетов предполагается, что непочечный клиренс и непочечное значение k при почечной недостаточности — величины постоянные. Фактически же в случае, если почечной недостаточности сопутствует сердечная недостаточность, метаболический клиренс многих лекарственных средств будет сниженным. Соответственно, если при сердечной недостаточности используют лекарственный препарат с узким терапевтическим индексом, такой как дигоксин, было бы разумной предосторожностью при расчете дозы приблизительно наполовину снизить величину непочечного клиренса (или k).
При почечной недостаточности также может происходить накопление активных или токсичных метаболитов лекарственных средств. Например, меперидин (лидол) выводится из организма главным образом посредством метаболизма, и его концентрации в плазме крови при почечной недостаточности меняются мало. Однако концентрация одного из его метаболитов (нормеперидина) в плазме крови заметно возрастает при нарушении его почечного выведения. Так как нормеперидин обладает большей судорожной активностью, чем меперидин, его накопление в организме больных с почечной недостаточностью, возможно, является причиной появления таких признаков возбуждения центральной нервной системы, как раздражительность, подергивание и судорожные припадки, развивающиеся в результате введения больших доз меперидина.
Метаболит новокаинамида М-ацетилновокаинамид действует на сердце аналогично действию его родительского препарата. Поскольку М-ацетилпрокаинамид выводится почти полностью почками, его концентрация в плазме крови возрастает при почечной недостаточности. Таким образом, нельзя оценить токсический эффект прокаинамида при почечной недостаточности, не учитывая действия его метаболитов.
Болезни печени. В отличие от предсказуемого уменьшения почечного клиренса лекарственных средств в случае снижения клубочковой фильтрации невозможно сделать общий прогноз влияния поражений печени на биотрансформацию лекарственных средств (гл. 243). Например, при гепатите и циррозе диапазон изменений клиренса лекарственного средства может уменьшаться или увеличиваться. Даже при запущенной гепатоцеллюлярной недостаточности величина клиренса лекарственного средства обычно уменьшается в 2—5 раз по сравнению с нормой. Однако степень таких изменений невозможно предсказать по результатам обычных исследований функции печени. Следовательно, даже в тех случаях, когда есть подозрение на нарушение печеночного клиренса лекарственного средства, нет оснований для корректировки дозового режима его введения, кроме оценки клинической реакции и определения его концентрации в плазме крови.
Особая ситуация возникает при портокавальном шунтировании, поскольку в этом случае уменьшается эффективный печеночный кровоток. В большей степени это оказывает влияние на те лекарственные средства, которые в норме имеют высокий индекс печеночной экстракции, поскольку их клиренс является главным образом функцией кровотока и уменьшение его приводит к снижению клиренса таких лекарственных средств (например, пропранолола и лидокаина). Кроме того, доля введенной перорально дозы лекарственного препарата, достигающая системы кровообращения, увеличивается, поскольку лекарственное средство минует печень во время процесса абсорбции, избегая тем самым метаболизма первичного прохождения в этом органе (например, меперидин, пентазоцин).
Нарушения кровообращения — сердечная недостаточность и шок. В условиях сниженной перфузии тканей происходит перераспределение минутного объема сердца таким образом, чтобы сохранить приток крови к сердцу и головному мозгу за счет других тканей (гл. 29). Вследствие этого лекарственное средство локализуется в меньшем объеме распределения, повышается концентрация его в плазме крови и в результате ткани подвергаются воздействию этой более высокой концентрации. Если головной мозг или сердце чувствительны к этому лекарственному препарату, их реакция на введение его меняется.
Кроме того, снижение перфузии почек и печени прямо или опосредованно нарушает выведение лекарственного средства этими органами. Таким образом, при тяжелой застойной сердечной недостаточности, геморрагическом или кардио-генном шоке реакция на обычную дозу лекарственного средства может быть чрезмерной, что потребует изменения величины дозы. Например, при сердечной недостаточности клиренс лидокаина снижается приблизительно на 50% и терапевтические уровни содержания его в плазме крови достигаются при скорости введения, равной примерно половине от необходимой в обычных условиях. Наблюдается также значительное уменьшение объема распределения лидокаина, что приводит к необходимости снижения нагрузочной дозы. Считают, что подобные ситуации характерны для прокаинамида, теофиллина и, возможно, хинидина. К сожалению, не существует прогностических признаков изменений фармакокинетики такого типа. Поэтому нагрузочные дозы должны быть заниженными и длительное лечение следует осуществлять при тщательном контроле клинических признаков токсичности и уровней содержания лекарственного средства в плазме крови.
Нарушение процессов связывания лекарственного средства с белками плазмы. Многие лекарственные средства циркулируют в плазме крови, будучи частично связанными с белками плазмы. Поскольку лишь несвязанное, или свободное, лекарственное средство может быть доставлено в фазе распределения к месту его фармакологического действия, лечебный эффект будет определяться не общей концентрацией циркулирующего в крови лекарственного средства, а концентрацией его свободной фракции. В большинстве случаев степень связывания лекарственного средства с белками постоянна во всем диапазоне терапевтических концентраций, так что индивидуализация терапии на основе общих уровней содержания лекарственного средства в плазме крови не вызовет значительной ошибки. Однако в случае таких состояний, как гипоальбуминемия, заболевания печени и почек, степень связывания, в особенности кислых или нейтральных лекарственных средств, снижается, и поэтому при любом значении уровня содержания препарата в плазме крови концентрация его свободной фракции повышается и возрастает риск токсического действия. При других состояниях, например инфаркте миокарда, хирургических операциях, злокачественных заболеваниях, ревматоидном артрите и ожогах, приводящих к повышению в плазме крови концентрации реактанта острой фазы — 1-кислого гликопротеина, возникнет противоположный эффект от основных лекарственных средств, связанных с этой макромолекулой. К числу лекарственных средств, для которых подобные изменения играют важную роль, относятся те, у которых в норме с белками плазмы связана большая их часть (>90%), поскольку небольшие колебания в степени связывания вызывают значительное изменение в количестве лекарственного средства, находящегося в свободном состоянии.
Последствия этих изменений в степени связывания с белками, особенно в отношении общего уровня содержания в плазме, определяются тем, зависят ли клиренс и распределение лекарственного средства от концентрации несвязанной фракции или же от общей концентрации в плазме крови. Для многих лекарственных средств выведение и распределение ограничиваются в основном их несвязанной фракцией, и поэтому снижение степени связывания ведет к увеличению клиренса и распределения. В результате этих изменений уменьшается период полувыведения. Изменение дозового режима в условиях пониженной степени связывания лекарственного средства с белками плазмы сводится к тому, что суточную дозу следует вводить не однократно, а разделив ее на части, с интервалами. Индивидуализация терапии в подобных случаях должна основываться на клинических, реакциях больного или на концентрации несвязанной фракции лекарственного средства в плазме крови. При этом важно, чтобы больному не вводилось лекарственное средство в количествах, рассчитанных на основе обычного терапевтического диапазона доз, определяемых по общей концентрации лекарственного средства в плазме крови, поскольку это приведет к чрезмерным реакциям организма на препарат и к возможным токсическим эффектам.
В том случае, если лекарственные средства связываются с ai-кислым гликопротеином, вызванное заболеванием увеличение степени связывания вызовет противоположный эффект—снижение клиренса лекарственного средства и его распределения. В соответствии с этим введение лидокаина с постоянной скоростью для купирования аритмии после инфаркта миокарда приводит к его накоплению в организме. Однако клиренс свободной и фармакологически активной фракции лекарственного средства остается по существу неизмененным. Крайне важно, чтобы необходимая для больного доза не определялась на основе общей концентрации препарата в плазме крови, поскольку это было бы связано с субтерапевтическими уровнями содержания его несвязанной фракции.
Дата добавления: 2015-03-17; просмотров: 857;
