Механизм экскреторной функции почек при нормальной и сниженной массе нефронов
Суточный объем экскретируемой мочи (около 1,5 л или приблизительно 1 мл/мин) представляет собой небольшой остаток, образующийся в результате двух во многих отношениях противоположных процессов, — ультрафильтрации 180 или более литров жидкости в сутки (приблизительно 125 мл/мин) через капилляры клубочков, с одной стороны, а с другой—регенерации (или реабсорбции) более 99% этого ультра фильтрата при помощи транспортных процессов, действующих в почечных канальцах. Значение почек на начальном этапе этого процесса в организме человека подчеркивается тем фактом, что в состоянии покоя через них проходит около 20% минутного объема сердца, в то время как на долю самих почек приходится менее 1% массы тела. Поэтому при расчете на единицу массы ткани приток крови к почкам оказывается намного большим, чем приток крови к другим неполым органам (включая сердце, головной мозг и печень), кровенасыщение которых обычно считают достаточно обильным.
Клубочковая ультрафильтрация. Образование мочи начинается с выработки безбелкового ультрафильтрата плазмы крови. Скорость ультрафильтрации через стенки клубочковых капилляров (скорость клубочковой фильтрации, СКФ) определяется тремя факторами: 1) соотношением давлений по обе стороны стенки капилляра (гидростатическое давление в капиллярах клубочков и онкотическое давление в полости их капсул способствуют фильтрации, в то время как онкотическое давление в капиллярах клубочков и гидростатическое давление в полости их капсул замедляют ее); 2) скоростью тока плазмы крови через клубочки; 3) проницаемостью и величиной общей поверхности фильтрующих капилляров. Снижения СКФ можно ожидать в случаях, если: 1) понижено гидростатическое давление в клубочках (как при гипотензивном шоке); 2) повышено гидростатическое давление в канальцах (а следовательно, и в капсулах почечных клубочков) (окклюзия мочеиспускательного канала или шейки мочевого пузыря); 3) онкотическое давление в плазме крови увеличивается до необычайно высоких значений (гемоконцентрация, обусловленная гипогидратацией; миеломная болезнь или другие виды диспротеинемии); 4) снижены ток крови и плазмы через почки (следовательно, и через клубочки) (недостаточность кровообращения, сердечная недостаточность) и 5) снижена проницаемость и/или суммарная фильтрующая поверхность (острый или хронический гломерулонефрит).
Несмотря на необычайно высокую скорость движения жидкости через стенку капилляров клубочков, все циркулирующие в крови белки плазмы, кроме белков, обладающих наименьшими размерами молекул, в норме не могут пройти через этот барьер. Молекулы, размер которых равен или менее размера молекул инсулина (мол. масса приблизительно 5200), в норме появляются в клубочковой моче в тех же самых концентрациях, в которых они содержатся в плазменной жидкости, в то время как транспорт веществ, обладающих молекулами, размер которых все в большей степени увеличивается, соответственно постепенно уменьшается и в норме достигает очень низких значений, когда размер их молекул становится равным размеру молекул альбумина плазмы крови. Считают, что основными барьерами при фильтрации белков служат базальная мембрана капилляров клубочков и щелевидные диафрагмы, соединяющие отростки смежных эпителиальных клеток на мочевой стороне стенки капилляров клубочков (см. рис. 40-1). В дополнение к этим механическим заслонкам существуют электростатические факторы, которые также задерживают фильтрацию белков плазмы, особенно альбумина. Молекула альбумина ведет себя как полианион в физиологическом растворе, и поэтому она задерживается высокоанионными гликопротеидами, содержащимися в различных слоях стенки клубочков. При нарушении этих механических и электростатических барьеров, как это происходит при многих видах повреждения клубочков (гл. 222—224), количество белков плазмы получает доступ в мочу.
Биологические последствия длительного снижения СКФ. Измерение суммарной СКФ обеих почек обеспечивает получение чувствительного и широко применяемого показателя общей экскреторной функции почек. При нарушении экскреторной функции почек, как остром, так и хроническом, происходят неблагоприятные изменения одного или нескольких факторов, определяющих величину СКФ в пораженных нефронах, что приводит к снижению общей величины СКФ. Степень этого снижения определяется суммой нарушений функций отдельных клубочков. Первоначально влияние таких нарушений СКФ единичного нефрона (СКФЕН), как бы малы они ни были, заключается в уменьшении суммарной скорости экскреции воды и тех растворенных в ней веществ, которые в норме содержатся в клубочковом ультрафильтрате. В стабильном состоянии такое снижение скорости фильтрации, когда оно сочетается со сравнительно сниженной скоростью экскреции, ведет к задержке и накоплению неэкскретированных веществ в жидкостях организма. Дальнейшее уменьшение СКФ будет увеличивать степень задержки этих веществ.
На рис. 218-1 изображены различные варианты реакции на такие нарушения процесса фильтрации. Степень снижения общей СКФ откладывают на оси абсцисс и выражают в процентах от ее значения в норме (100%). Для различных растворенных веществ, в норме содержащихся в клубочковом фильтрате, характерны три основных типа реакции, представленные кривыми А, Б и В. Кривая А описывает тип реакции, наблюдаемый для таких веществ, как креатинин и мочевина, экскреция которых в мочу в норме зависит в основном от клубочковой фильтрации, т. е. секреция не оказывает значительного влияния на уровень их экскреции с мочой. Поэтому по мере снижения СКФ уровень содержания в плазме крови креатинина, мочевины и других веществ, которые в норме экскретируются главным образом посредством фильтрации, постепенно увеличивается, хотя и нелинейным образом.
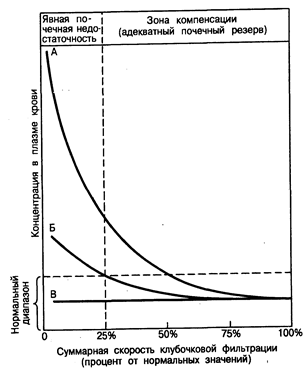
Рис 218-1. Характерные типы адаптации для различных видов веществ, растворенных в жидкостях организма, при хронической почечной недостаточности. (Из NS. Bricker et al., in Brenner and Rector, 2d ed.)
Клиническое течение хронической почечной недостаточности (ХПН) обычно также соответствует типу реакции, описываемой кривой А. Больным с ХПН обычно свойственны длительный бессимптомный период «компенсации» и быстропротекающая, характеризующаяся наличием клинических симптомов терминальная фаза. Другими словами, хроническое повреждение почек, приводящее к медленно протекающей, но неотвратимой деструкции массы нефронов, вызывает постепенное, но умеренное повышение уровней содержания креатинина и мочевины в плазме крови, но не до значений, выходящих за пределы диапазона их нормальных величин, несмотря на снижение величины суммарной СКФ вплоть до 50%. Однако при дальнейшей потере массы нефронов и снижении СКФ (даже если скорость деструкции нефронов и не будет возрастать) пределы почечного резерва будут превышены и длительное накопление растворенных веществ (кривая А) приводит к концентрациям этих веществ в плазме крови, превышающим диапазон их нормальных значений (см. рис. 218-1). Поскольку, как полагают, эти накапливающиеся растворенные вещества оказывают «токсическое» действие на все системы органов, то проявления ХПН в этой стадии становятся явными. Вследствие этого у больных со сниженной массой почек даже небольшое дополнительное уменьшение общей СКФ может означать переход из состояния «компенсации» к явной уремии.
Накопление растворенных веществ (кривая А) при прогрессирующей почечной недостаточности продолжается до тех пор, пока не будет достигнуто их внешнее равновесие, т.е. скорость приобретения и/или продуцирования этих веществ и скорость их экскреции станут сравнительно равными друг другу. Например, в случае креатинина, предполагая наличие постоянной скорости образования креатинина, снижение СКФ на 50% приведет к удвоению концентрации креатинина в плазме крови. Такая концентрация восстановит фильтрующуюся порцию креатинина (определяемую как СКФ, умноженную на концентрацию креатинина в. плазме крови) до уровня, существовавшего до заболевания, и скорость его экскреции с мочой опять станет равной скорости продуцирования креатинина. К сожалению, поскольку в организме человека не существует механизмов, которые могли бы увеличить экскрецию креатинина сверх этого уровня, элиминация накопленного креатинина невозможна, и его концентрация в плазме крови останется вдвое выше нормы. При прогрессирующем снижении СКФ уровни креатинина в плазме крови будут продолжать возрастать, что обусловливается как дальнейшим снижением экскреторной функции нефронов, так и задержкой креатинина, вызванной ранее произошедшей деструкцией последних (см. рис. 218-1). Практически до тех пор, пока скорости приобретения и продуцирования остаются близкими к постоянным, обратно пропорциональная зависимость между величиной СКФ и концентрациями в плазме крови таких растворенных в ней веществ, как креатинин и мочевина является достаточно надежной и предсказуемой, что позволяет использовать уровни содержания этих веществ в плазме крови в качестве полезных клинических показателей СКФ.
В отличие от растворенных веществ типа описываемых кривой А, уровни содержания в плазме крови таких веществ, как фосфаты, ураты, а также ионы калия (К'1') и водорода (Н^ ), обычно не возрастают сверх диапазона их нормальных значений до тех пор, пока СКФ не снизится до очень низких значений (несколько процентов от нормы). При прогрессирующей почечной недостаточности этот тип реакции, описываемой кривой Б на рис. 218-1, отражает участие механизмов канальцевого транспорта, вносящих свой вклад в экскрецию этих веществ. Иными словами, по мере снижения СКФ канальца способствуют экскреции все увеличивающейся доли фильтрующейся порции этих веществ путем увеличения самой их секреции и/или посредством снижения их реабсорбции. Поэтому уровни содержания в плазме крови растворенных в ней веществ типа описываемых кривой Б возрастают в гораздо меньшей степени, чем уровни содержания веществ типа описываемых кривой А, поскольку при прогрессирующем уменьшении СКФ происходит увеличение как доли экскреции, приходящийся на единичный нефрон, так и фракционной экскреции. Однако, в конце концов, повышенной фракционной экскреции становится недостаточно для того, чтобы компенсировать уменьшение фильтрующейся порции этих веществ, вызываемое заметным снижением СКФ, и уровни их содержания в плазме крови возрастают сверх диапазона их нормальных значений (см. рис. 218-1). Что касается уратов, фосфатов и ионов К+, то повышенная фракционная экскреция обычно служит для поддержания нормальных уровней их содержания в плазме крови до тех пор, пока СКФ не снизится до значения меньшего 25% ее нормальной величины.
И наконец, концентрации в плазме крови некоторых растворенных в ней веществ, таких как хлорид натрия (NCl), остаются фактически постоянными и сохраняются в диапазоне нормальных значений на протяжении всего периода протекания ХПН, несмотря на постоянное поступление этих веществ в организм в обычных количествах. Такие вещества соответствуют типу реакции, описываемому кривой В на рис. 218-1. Степень компенсации при этом почти полная и представляет собой основу адаптации к повреждению почек. Чтобы показать степень достигнутой адаптации, полезно сравнить экскрецию Na+ у человека, обладающего нормальной экскреторной функцией почек (СКФ равна 125 мл/мин) с экскрецией Na+ у больного с выраженной почечной недостаточностью (СКФ равна 2 мл/мин). Обоим разрешен пищевой рацион, содержащий 7 г поваренной соли в сутки (120 ммоль Na+). При концентрации ионов Na+ в сыворотке крови в норме, равной 140 ммоль/л, наружный баланс Na+ достигается у здорового человека путем экскреции приблизительно 0,5% фильтрующейся порции этих ионов. В противоположность этому для поддержания наружного баланса у больного с ХПН фракционная экскреция ионов Na+ должна возрасти до 30%. Иными словами, обеспечение наружного баланса ионов требует, чтобы у больного с ХПН в мочу экскретировалось в сутки такое же количество Na+ (120 ммоль), как и у здорового человека. Учитывая, что у больного с ХПН СКФ снижается значительно, обеспечение наружного баланса может быть достигнуто только посредством прогрессирующей трансформации процессов реабсорбции Na+ в остав шихся сохранными канальцах, в результате чего прогрессивно увеличивающаяся часть фильтрующейся порции Na+ не подвергается реабсорбции и попадает в дефинитивную мочу. Короче говоря, доля экскреции Na+ приходящаяся на оставшийся сохранным единичный нефрон, возрастает в обратно пропорциональной зависимости от суммарной величины СКФ в оставшихся сохранными нефронах.
Механизмы канальцевого транспорта при нормальной и сниженной массе нефронов. Нарушение функции почек почти при всех формах их прогрессирующего поражения сопровождается прогрессирующим нарушением морфологии органа и изменением его структуры. Несмотря на эти структурные изменения, функции клубочков и канальцев в пораженной почке часто остаются столь же тесно взаимодействующими, т. е. сохраняющими клубочково-канальцевый баланс, как и в здоровом органе, по меньшей мере до развития терминальной стадии ХПН. Лежащее в основе этой гипотезы интактного нефрона предположение состоит в том, что после потери массы нефронов остаточная функция почек поддерживается главным образом за счет деятельности остающихся сохранными здоровых нефронов, в то время как пораженные нефроны считаются переставшими функционировать. Существуют убедительные данные, позволяющие предположить, что, несмотря на прогрессирующую деструкцию нефронов, многие из механизмов, участвующих в обеспечении баланса воды и растворенных в ней веществ, отличаются только количественно, но не качественно от соответствующих механизмов, которые, как полагают, поддерживают гомеостаз воды и растворенного в ней вещества при нормальном физиологическом состоянии. Наиболее важные аспекты этой проблемы рассматриваются ниже.
Канальцевый транспорт хлорида натрия и воды в здоровом органе. Большая часть фильтруемых в сутки воды и солей натрия реабсорбируется канальцами и попадает в дефинитивную мочу. Около 60% клубочкового ультрафильтрата реабсорбируется в проксимальном канальце, причем осмоляльность или концентрация ионов Na+ в неабсорбированной фракции изменяется незначительно (рис. 218-2). Иными словами, реабсорбция жидкости в проксимальном канальце происходит почти изотонично и сопровождается активным транспортом Na+. Поскольку Сl– и НСО3– представляют собой основные анионы во внеклеточной жидкости, большая часть отфильтрованных ионов Na+ реабсорбируется с этими анионами. В начальной извитой части проксимального канальца основным анионом, сопровождающим реабсорбцию натрия, является бикарбонат. Этот процесс происходит посредством механизма обмена Na+/H+ в щеточной каемке клеток в просвете канальца и зависит как от цистоангидразы, так и от карбоангидразы щеточной каемки. Глюкоза, аминокислоты и другие органические растворенные вещества (например, лактат) также интенсивно реабсорбируются в проксимальном извитом канальце при помощи сопутствующего транспортного процесса, связывающего поступление этих органических субстратов в клетки с ионами Na+. По-видимому, действуют три сопутствующих друг другу процесса, связывающих абсорбцию воды (т. е. объем) с абсорбцией в проксимальном канальце растворенного в ней вещества. Во-первых, это означает, что, учитывая чрезвычайно высокую проницаемость для воды этого отдела нефрона, наличие даже очень незначительной разницы в осмоляльности по обе стороны эпителия (т.е. гипотоничность в просвете канальца порядка 2—3 мосм, обусловленная абсорбцией растворенного вещества) может стимулировать абсорбцию воды (объема). Во-вторых, благодаря предпочтительному абсорбированию НСО3– и органических растворенных веществ в начальных отделах проксимального канальца концентрация этих веществ будет снижаться, в то время как концентрация Сl– будет возрастать по мере прохождения по всей длине проксимального канальца. Абсорбция воды будет осуществляться в том случае, если диффузия Na+ и Сl~ в соответствии с их электрохимическими градиентами будет происходить быстрее, чем обратная диффузия бикарбоната натрия в просвет канальца. И, наконец, эффективный осмотический градиент (несмотря на одинаковую макроскопическую осмоляльность) жидкостей, находящихся в просвете канальца и вокруг него в том случае, если эффективная осмоляльность, создаваемая Сl в просвете канальца, будет выше, чем обусловленная бикарбонатом осмоляльность в перитубулярной жидкости.
На скорость реабсорбции жидкости из проксимальных извитых канальцев и перитубулярного интерстиция влияют некоторые физические факторы, например гидростатическое и коллоидное осмотическое (онкотическое) давление, действующее через стенки перитубулярных капилляров. Поскольку белки плазмы в клубочковых капиллярах концентрируются в процессе ультрафильтрации, онкотическое давление заметно возрастает по мере движения плазмы по сети клубочковых капилляров. Это ступенчатое повышение онкотического давления плазмы передается почти неизмененным в перитубулярные капилляры через эфферентные артериолы. Однако в этих резистентных сосудах гидростатическое давление значительно снижается и поэтому, когда плазма достигает перитубулярных капилляров, онкотическое давление в них значительно превышает гидростатическое. Поэтому силы Старлинга здесь ориентированы на поглощение, тогда как в клубочке, где гидростатическое давление превышает онкотическое, они ориентированы на фильтрацию. Полагают, что степень превышения величины онкотического давления в сети перитубулярных капилляров и есть фактор, регулирующий суммарную скорость реабсорбции жидкости в проксимальных канальцах. Поэтому в тех случаях, когда в перитубулярных капиллярах понижается онкотическое или повышается гидростатическое давление, поглощение жидкости этими капиллярами уменьшается. В результате этого жидкость задерживается в интерстициальном пространстве, изменяя гидростатическое давление в нем и в конечном итоге замедляя выход жидкости из боковых внутриклеточных каналов. Если нет адекватного пути дренирования, жидкость из этих каналов перетекает обратно в просвет почечного канальца и снижает суммарную реабсорбцию жидкости этим участком канальцев. Противоположные процессы развиваются в тех случаях, когда в перитубулярных капиллярах происходит увеличение онкотического давления (увеличение фильтрующей доли) или снижение гидростатического давления (увеличение тонуса эфферентных артериол). В этих условиях, увеличивается поглощение реабсорбента перитубулярными капиллярами, что ведет в конечном итоге к повышенной реабсорбции жидкости проксимальным канальцем.
В отличие от процессов в проксимальном канальце в тонкой части петли нефрона не происходит активного транспорта NaCl из просвета канальца в перитубулярную кровь. Однако, как показано на рис. 218-2, там имеет место пассивный транспорт солей. В следующем за проксимальным отделе нефрона, в медуллярной толстой восходящей части петли нефрона, концентрация NaCI снижена ниже уровня, отличаемого в начале этого отдела нефрона. Здесь абсорбция Сl~ осуществляется при помощи активного процесса, включающего в себя фуросемидочувствительный Na+:K+:Cl–—сопутствующий транспортный механизм в мембране просвета канальца; при этом 50% абсорбции Na+ происходит пассивно и стимулируется положительным электрическим зарядом эпителия просвета канальца. Поскольку восходящая часть петли нефрона всегда проницаема для воды, суммарная реабсорбция NaCl не только обусловливает гипотоничность канальцевой жидкости, но и вызывает увеличение концентрации NaCl в наружном медуллярном интерстиции (см. рис. 218-2). У животных некоторых видов антидиуретический гормон (АДГ) увеличивает абсорбцию NaCl, но не проницаемость для воды медуллярного участка толстой восходящей части петли нефрона, хотя влияние этого гормона на указанный выше отдел нефрона у человека не выяснено.
В жидкости, покидающей толстую восходящую часть петли нефрона, концентрация NaCl достаточно низка, причем это не зависит от пищевого рациона или от содержания воды в организме. Реабсорбция воды в дистальном извитом канальце зависит от содержания воды в организме или, точнее, от наличия или отсутствия АДГ в плазме крови. При отсутствии АДГ рассматриваемый или более дистально расположенный отделы нефрона непроницаемы для воды, и поэтому гипотоничная жидкость, поступающая в этот отдел, экскретируется в виде разведенной мочи. Естественно, что длительно происходящая реабсорбция соли на всем протяжении дистального извитого канальца ведет к еще большему разведению мочи. В присутствии АДГ проницаемость для воды конечного участка этого отдела нефрона возрастает, в результате чего осмоляльность жидкости в конечной части дистального канальца возрастает до значений, близких к осмоляльности плазмы крови. Продолжается реабсорбция NaCl из просвета канальца, преодолевающая умеренно высокие химический и электриче ский градиенты. Процесс реабсорбции NaCl в этом отделе нефрона стимулируется альдостероном.
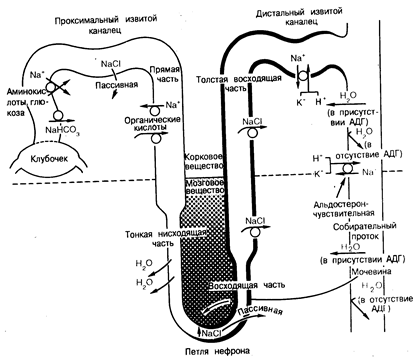
Рис. 218-2. Транспортные функции различных анатомических отделов нефрона у млекопитающих.
Реабсорбция жидкости через проксимальный каналец — изоосмотический процесс, ответственный за реабсорбцию приблизительно 60% фильтруемого количества ионов Na+ Н2О. Большая часть фильтруемых НСО3–, аминокислот и глюкозы реабсорбируется в начальном участке извитого проксимального канальца. Реабсорбция глюкозы и аминокислот ассоциирована с транспортом Na+ поэтому создает отрицательный потенциал в просвете канальца. В то же время анионы НСО3–реабсорбируются при помощи неэлектрогенного механизма, посредством секреции ионов Н+. Активный транспорт этих растворенных веществ приводит к их трансэпителиальной концентрации и созданию эффективных градиентов осмотического давления, способствующих току Н2O из проксимального канальца в перитубулярные капилляры. Увеличение концентрации ионов Сl– в жидкости, содержащейся в канальце, можно рассматривать как результат снижения концентрации НСО3– в просвете канальца. Повышение в результате этого концентрации Сl– становится фактором, определяющим наружный пассивный транспорт Сl–, снижающий его концентрационный градиент, что приводит к возникновению положительного потенциала в просвете конечного участка извитого проксимального канальца. Прямые части проксимального канальца способны к активному электрогенному транспорту Na+, не зависящему от транспорта органического растворенного вещества. При нормальных условиях приблизительно одна треть клубочкового фильтрата попадает в нисходящую часть петли нефрона. Поскольку тонкая нисходящая часть петли нефрона неспособна к активному транспорту NaCl за пределы просвета канальца и характеризуется низкой проницаемостью для ионов Na+, но высокой проницаемостью для Н2О, то Н2О пассивно извлекается из нее по мере приближения жидкости к изгибу петли нефрона. Таким образом, в тонкую восходящую часть петли нефрона поступает гипертоническая жидкость с повышенной концентрацией NaCl, но с меньшей концентрацией мочевины по сравнению с концентрациями в окружающем интерстиции мозгового вещества. Эта часть петли нефрона отличается от ее нисходящей части тем, что она в значительной степени непроницаема для Н2O и мочевины, но в высокой степени проницаема для NaCl. Эти ее особенности дают возможность осуществления пассивной диффузии NaCl наружу из восходящей части петли нефрона. Активный электрогенный транспорт NaCl через непроницаемую для воды толстую восходящую часть петли нефрона позволяет осуществить разделение растворенного вещества и воды. Вследствие этого канальцевая жидкость становится разведенной, а интерстиции мозгового вещества — гипертоничным. Независимо от конечного значения осмоляльности мочи, поступающая в дистальный извитой каналец жидкость будет всегда гипоосмотична. В этом отделе нефрона осуществляется активная реабсорбция ионов Na+. Дистальный извитой каналец, за исключением терминальной его части, непроницаем для воды даже в присутствии АДГ. Альдостерон оказывает свое действие в этом отделе, увеличивая реабсорбцию Na+, которая в различной степени связана с секрецией К+ и Н+. Свое основное влияние АДГ оказывает в кортикальных и сосочковых отделах собирающего протока. Проницаемость этих отделов для Н2О в отсутствие АДГ очень низка, но она может значительно возрастать в присутствии последнего. Эти отделы характеризуются также активной реабсорбцией Na+, которая, по-видимому, зависит от присутствия минералокортикоида. В отсутствие АДГ собирательный проток непроницаем для воды, так что через него протекает гипотоничная канальцевая жидкость. Однако в присутствии АДГ в нем происходит интенсивная реабсорбция воды, приводящая к тому, что дефинитивная моча становится гипертоничной.
Кортикальный собирающий каналец обладает чрезвычайно малой проницаемостью для воды в отсутствие АДГ в то время, как в присутствии последнего его проницаемость значительно увеличивается. Чувствительность этого отдела нефрона к АДГ, по-видимому, более выражена, чем чувствительность к АДГ дистального извитого канальца. Как и дистальный извитой каналец, кортикальный собирательный каналец обладает способностью к увеличению активной реабсорбции NaCl.
Терминальным отделом дистального нефрона служит сильно разветвленный сосочковый собирающий проток. Длительно осуществляемый транспорт электролитов в этом отделе приводит к образованию большой разницы в величинах концентрации ионов, обычно существующей между мочой и плазмой крови. Как и в кортикальном собирающем канальце, транспорт Na+, по-видимому, является активным, поскольку реабсорбция происходит в направлении, противоположном значительным электрохимическим градиентам. Интенсивность транспорта Na+ в этом отделе нефрона зависит от пищевого рациона и от количества Na+, попадающего сюда из более проксимально расположенных отделов; транспорт Na+ стимулируется альдостероном. Проницаемость этого отдела нефрона для воды заметно возрастает в присутствии АДГ.
Влияние сниженной массы нефронов на транспорт хлорида натрия в остающихся сохранными нефронах. При прогрессирующей деструкции нефронов для поддержки наружного баланса NaCl требуется, чтобы фракционная экскреция соли возрастала по мере уменьшения СКФ. Весьма вероятно, что это адаптивное увеличение фракционной экскреции соли обеспечивается при помощи нескольких механизмов. При уменьшении количества функционирующих нефронов может происходить изменение величины гидростатического и онкотического давлений в перитубулярных капиллярах в направлениях, способствующих подавлению реабсорбции NaCl и воды в проксимальном канальце. Например, увеличение гидростатического давления в перитубулярных капиллярах, угнетающее реабсорбцию жидкости в проксимальных канальцах, возможно при артериальной гипертензии, которая является обычным явлением у больных с почечной недостаточностью. Аналогично можно ожидать уменьшения онкотического давления в перитубулярных капиллярах при повреждении почек, как из-за уменьшения фильтруемой фракции, так и в результате гипоальбуминемии. Хотя у животных такие изменения в перитубулярных факторах явно вызывают снижение реабсорбции жидкости в проксимальных канальцах в ответ на снижение величины СКФ, у человека подобные изменения с достоверностью не установлены. Альдостерон, являющийся важным фактором, определяющим величину реабсорбци Na+ в дистальных отделах нефрона, вероятно, нельзя рассматривать в качестве основного фактора, вызывающего снижение фракционной реабсорбции Na+, поскольку концентрация альдостерона в плазме крови редко уменьшается при ХПН. Кроме того, было показано, что наружный баланс Na+ можно сохранить с помощью введения фиксированных доз минералокортикоидных гормонов больным уремией собакам, которым была проведена двусторонняя адреналэктомия. Еще один фактор, к которому привлечено внимание в связи с его участием в подавлении фракционной реабсорбции Nad при ХПН, связан с накоплением растворенных веществ по мере снижения СКФ. Помимо накопления мочевины и креатинина, происходит также накопление в организме множества органических кислот (включая гиппураты). В норме эти вещества экскретируются как посредством фильтрации, так и канальцевой секреции; последний процесс включает в себя транспортную систему органической кислоты при участии носителей в эпителии проксимальных канальцев. Если величина СКФ снижена и уровни концентрации этих органических кислот в плазме крови возрастают, то секреция достаточного количества жидкости может сопутствовать выделению этих анионов органических кислот в просвет проксимального канальца (посредством осмоса), уменьшая тем самым реабсорбцию жидкости и даже способствуя самой секреции жидкости. Доказательства в поддержку существования такого механизма были получены при проведении исследований, в которых сыворотка крови больных уремией оказалась способной индуцировать секрецию жидкости в исследуемых in vitro изолированных проксимальных канальцах кроликов.
Было высказано .также предположение о том, что транспорт NaCl через почечные канальцы млекопитающих может регулироваться, по меньшей мере частично, натрийуретическим гормоном. В поддержку такой возможности были опубликованы сообщения о том, что в сыворотке крови и в моче больных уремией людей и собак содержатся факторы, способные угнетать транспорт NaCl через кожу лягушки, мочевой пузырь жабы и почечный каналец крысы. Однако за накопление натрийуретических факторов при уремии, возможно, придется расплачиваться; «плата» за поддержание наружного баланса Na+ заключается в возможности возникновения нарушений транспорта Na+ через клеточные мембраны, что часто случается при запущенной почечной недостаточности. Эта возможность обсуждается подробнее в гл. 220.
Обязывающе высокая скорость экскреции растворенных веществ через оставшийся сохранным нефрон (так называемый осмотический диурез, обусловленный мочевиной и другими задержанными веществами) также может вносить свой вклад в увеличение фракционной экскреции NaCl, примерно так, как это происходит у здоровых людей после введения им нереабсорбируемых растворенных веществ, таких как маннит. И наконец, при определенных формах ХПН наблюдается тенденция к необычно большим потерям солей с мочой. К числу таких солеистощающих нефропатий относятся хронический пиелонефрит и другие тубулоинтерстициальные заболевания (гл. 226), так же как и поликистоз и кисты мозгового вещества. Общим для этих болезней является более выраженная деструкция мозгового вещества и интерстиция, чем повреждение кортикальной и клубочковой частей паренхимы. Поэтому в основе наблюдаемой тенденции к потерям большого количества солей при этих состояниях может лежать предпочтительное нарушение реабсорбционной функции канальцев, а не первичное снижение СКФ. Ряд клинических расстройств, связанных с изменением физиологических превращений NaCl в почках при ХПН (включая гипо- и гиперволемию, гипертензию и т. д.), обсуждаются в гл. 220.
Влияние сниженной массы нефронов на реабсорбцию воды в остающихся сохранными нефронах. Как и в случае с NaCl, по мере развития почечной недостаточности происходит прогрессирующее увеличение фракционной экскреции воды, поэтому даже у такого больного, у которого величина суммарной СКФ составляет 5 мл/мин или менее, почки обычно бывают способны поддерживать наружный водный баланс. Адаптационные изменения физиологических превращений воды в почечных канальцах пораженной почки играют важную роль в патогенезе нарушения способности концентрировать мочу и, следовательно, в развитии полиурии и никтурии (гл. 40). Для того чтобы разобраться в существе действующих механизмов, следует сравнить соответствующие реакции организма здорового человека и больного уремией, нацеленные на поддержание наружного баланса. Если принять, что у обоих индивидуумов пищевой рацион и количество поглощаемой жидкости одинаковы, то значения суммарной экскреции растворенных веществ и жидкости (объем) также должны быть одинаковыми. Если предположить, что обязательная солевая нагрузка, которая должна быть экскретирована у каждого индивидуума, составляет 600 мосм/сут, а осмоляльность мочи равна 300 мосм/кг, то для обеспечения экскреции суммарной солевой нагрузки каждому из них потребуется объем мочи, равный 2 л/сут. Если значения СКФ у здорового человека и у больного уремией составляют соответственно 180 и 4 л/сут, то экскреция объема мочи, равного 2 л/сут, будет соответствовать у здорового человека экскреции немногим более 1% отфильтрованной воды, в то время как у больного уремией она будет соответствовать он /д. Поскольку диапазон значений осмоляльности мочи, который могут обеспечить пораженные почки (250—350 мосм/кг) намного уже, чем этот диапазон для сохранных почек (40—1200 мосм/кг), то здоровый человек способен экскретировать обязательную суточную солевую нагрузку, равную 600 моем, или в столь малом объеме мочи, как 500 мл/сут, или в столь большом, как 15 л/сут, в то время как этот диапазон для больного с почечной недостаточностью составляет лишь 1,7—2,4 л/сут.
При ХПН ограниченная способность концентрировать мочу тесно взаимосвязана с другими признаками нарушения функции почек. Поэтому при СКФ ниже 25 мл/мин у больного почти всегда определяется изостенурия. При такой и более низкой величине СКФ осмоляльность мочи не возрастает даже при парентеральном введении супрамаксимальных доз АДГ; это позволяет предположить, что нарушение концентрационной способности почек связано не только с ее утратой в пораженных нефронах, но также и с нарушением в оставшихся сохранными нефронах. Как уже говорилось, снижению массы функционирующих нефронов сопутствует одновременное увеличение фракционной экскреции ряда растворенных веществ. Вследствие этого обеспечение диуреза растворенного вещества, приходящегося на один нефрон, требует почти изоосмотическое количество жидкости и предотвращает выработку как гипотоничной, так и гипертоничной мочи. Вызванные заболеванием нарушения структуры мозгового вещества почек (петель нефронов, прямых каналов), нарушения кровотока в мозговом веществе почек и нарушения транспорта NaCl в восходящей части петли нефрона, несомненно, также вносят свой вклад в нарушение способности почек концентрировать мочу. И наконец, существуют данные, позволяющие предположить, что уремия сама по себе может вызывать нарушение реакции терминальных отделов нефрона на действие АДГ.
Поскольку больные с почечной недостаточностью не способны экскретировать концентрированную мочу, они должны потреблять адекватные количества жидкости для того, чтобы обеспечить экскрецию суммарной суточной солевой нагрузки. По этой причине ограничение потребления жидкости может оказаться чрезвычайно опасным для больных с ХПН. Таким же образом нарушение способности почек к разведению мочи воспрепятствует у многих больных возможности экскретировать большие количества потребляемой ими жидкости. Последствия различных видов нарушения экскреции воды у больных с ХПН, включая тенденции к развитию гипо- и гипернатриемии, рассмотрены в гл. 41 и 220.
Канальцевый транспорт фосфатов при нормальной и сниженной массе нефронов. При нормальных физиологических условиях около 80—90% фильтруемых фосфатов реабсорбируются главным образом в проксимальном канальце. Паратгормон (ПГ), усиливая экскрецию фосфатов посредством угнетения процесса реабсорбции в проксимальных канальцах (гл. 335), играет ключевую роль в поддержании гомеостаза фосфатов. У здоровых людей при увеличении содержания фосфатов в пищевом рационе обычно наблюдается преходящее повышение концентрации фосфатов в плазме крови. Это приводит к такому же преходящему снижению концентрации ионизированного кальция в плазме (обусловленному главным образом отложением фосфата кальция в костях), которое в свою очередь стимулирует секрецию ПГ. Увеличивая фракционную экскрецию фосфатов, ПГ восстанавливает наружный баланс фосфатов и их нормальное содержание в крови (нормофосфатемия). Это в свою очередь способствует возвращению к норме уровней содержания ионизированного кальция в плазме крови, тем самым устраняя стимул к высвобождению ПГ и восстанавливая нормальное состояние всех элементов системы контроля за концентрацией фосфатов.
При прогрессирующем поражении почек и постоянном количестве поступающих в организм фосфатов наружный баланс последних достигается прогрессиру ющим снижением их фракционной реабсорбции. Повышенная секреция ПГ является важным фактором, определяющим такой характер фосфатной реакции на сниженную массу нефронов. С каждой последующей ступенью снижения величины СКФ снижается общее количество фосфатов, отфильтрованных оставшимися сохранными клубочками, что ведет к преходящей задержке фосфатов в организме и, следовательно, к увеличению (хотя и небольшому) концентрации фосфатов во внеклеточной жидкости, включая и плазму крови. Это увеличение концентрации фосфатов в плазме крови приводит к небольшому ответному снижению концентрации ионизированного кальция в плазме крови и соответствующему увеличению секреции ПГ. Хотя считается, что такая фосфатная реакция оставшихся сохранными канальцев в ответ на увеличение уровня циркулирующего в крови ПГ восстанавливает уровни содержания фосфатов и, следовательно, уровни содержания кальция в плазме крови до нормальных значений (по меньшей мере во время стадии «компенсации» ХПН, описываемой участком со сравнительно плавным подъемом кривой Б на рис. 218-1), биологической ценой такого возвращения к нормофосфатемии и к нормокальциемии является стойкое повышение концентрации ПГ в плазме крови. При дальнейшем снижении СКФ будут повторяться все стадии этого процесса, но будет непрерывно возрастать и его цена, а именно разовьется прогрессирующее повышение уровня содержания ПГ в циркулирующей крови. Полагают, что по меньшей мере еще два процесса вносят свой вклад в развитие повышенной концентрации ПГ при почечной недостаточности. Один из них связан с резистентностью костей к кальциемическому действию ПГ, наблюдаемому при уремии. Это обусловливает необходимость превышающего норму содержания ПГ в циркулирующей крови, чтобы обеспечить требуемое приращение концентрации кальция в сыворотке крови. Второй процесс проистекает из того факта, что уменьшение массы почек приводит к нарушению их способности разрушать циркулирующий в крови ПГ. Тот факт, что характер изменения транспорта фосфатов более соответствует их протеканию для растворенного вещества, описываемого кривой типа Б, а не кривой типа В (см. рис. 218-1), указывает на то, что эти виды адаптации имеют ограниченный характер; в конечном счете при снижении СКФ ниже 25 мл/мин происходит задержка фосфатов в организме.
Поскольку ПГ оказывает выраженное биологическое действие как на кости, так и на почечные канальцы, наружный баланс фосфатов при ХПН достигается за счет повышенных уровней содержания ПГ, которые в свою очередь ответственны за многие изменения в костях, происходящие при нефрогенной остеопатии (т.е. вторичном гиперпаратиреозе, см. рис. 220-1). Данные, полученные в экспериментах на больных ХПН животных в поддержку этой остроумной гипотезы «стоимости», позволяют предположить, что если количество поступающих в организм с пищей фосфатов будет уменьшаться пропорционально снижению СКФ, то для поддержания наружного баланса фосфатов больше не потребуется увеличения их фракционной экскреции в оставшихся сохранными нефронах. Соответственно больше не будет происходить увеличения концентрации циркулирующего в крови ПГ, и типичные для вторичного гиперпаратиреоза костные изменения уменьшатся или их возникновение будет предотвращено.
Уменьшение массы почек вызывает нарушение фосфорного и кальциевого баланса и внутрикостного обмена веществ посредством механизмов, в значительной степени не зависимых от нарушенной экскреторной функции. Почки в норме являются тем основным местом, где происходит обменное превращение витамина D3 в его активные метаболиты. В то время как тенденция к развитию вторичного гиперпаратиреоза (по меньшей мере теоретически) возникает тогда, когда будет разрушен один нефрон, нарушение биотрансформации витамина D3 обычно не выявляется до тех пор, пока СКФ не снизится до значения ниже 25% от ее нормальной величины. Как будет показано в гл. 336, предшественники активной формы витамина D3, синтезированные в почке или поступившие с пищей, подвергаются начальному гидроксилированию в печени, что приводит к образованию 25-гидроксивитамина D3 [25 (ОН) D3]. В почках происходит второй важный этап гидроксилирования, ведущий к образованию 1,25-дигидроксивитамина D3 [l,25(OH)2D3]. Эта активированная форма витамина D способствует увеличению абсорбции кальция и фосфора в кишечнике, а также усилению процесса резорбции этих ионов из костей. Кроме того, l,25(OH)2D3, возможно, противодействует фосфатурическому действию ПГ на уровне почечного канальца, скорее усиливая, а не уменьшая реабсорбцию фосфора. При прогрессирующей почечной недостаточности снижение массы почек вызывает нарушение процесса гидроксилирования витамина D; было показано также, что задержка фосфора угнетает эту важную реакцию гидроксилирования. Снижение концентрации циркулирующего в крови l,25(OH)2D3, подавляя абсорбцию кальция в кишечнике, вносит дополнительный вклад в развитие гипокальциемии и появление избыточных концентраций ПГ при ХПН, последствия чего рассматриваются в гл. 220.
Транспорт водорода и бикарбоната при нормальной и сниженной массе нефронов. Как показано в гл. 42, величина рН внеклеточной жидкости у человека в норме поддерживается в узких пределах, равных 7,36—7,44, несмотря на временные различия в количестве кислот, поступающих в жидкости организма из пищи или в результате обменных процессов (приблизительно 1 ммоль Н+ на 1 кг в сутки). Эти кислоты поглощают как внутриклеточные, так и внеклеточные буферы, из которых самым важным во внутриклеточной субстанции является бикарбонат (НСО3–). Такое буферное действие сводит к минимуму изменения величины рН, которые в противном случае могли бы произойти. Однако буферная система НСО3– принесла бы мало пользы в долгосрочной перспективе, если бы не действовали механизмы гомеостаза, поскольку при неиссякающем пополнении организма нелетучими кислотами из пищи или в результате обменных процессов ее буферная способность истощилась бы, что в конечном счете привело к развитию смертельного ацидоза. Нормально функционирующая почка предотвращает такую возможность, регенерируя НСО3–, тем самым поддерживая соответствующую концентрацию аниона в плазме крови. В дополнение к генерированию НСО3– в почках также утилизируется по существу все его количество, имеющееся в клубочковом ультрафильтрате. Этот процесс реабсорбции происходит главным образом в проксимальном канальце и фактически полностью завершается в нем при концентрации НСО3– в сыворотке крови ниже критической — пороговой концентрации, которая у человека в норме равна приблизительно 26 мэкв/л, как и концентрация в плазме крови. В результате этого предотвращается потеря НСО3– с мочой. С другой стороны, если концентрация НСО3– возрастает до величины, превышающей пороговый уровень, реабсорбция его становится менее полной, и в итоге избыток анионов попадает в дифинитивную мочу, возвращая концентрацию НСО3– в плазме крови к пороговому уровню. Несмотря на реабсорбцию всего отфильтрованного количества НСО3–, метаболический ацидоз все равно развился бы, если бы не происходила постоянная регенерация НСО3–, поглощенного при буферном взаимодействии с сильными нелетучими кислотами.
Реабсорбция отфильтрованной НСО3– в проксимальном канальце происходит при помощи следующего механизма. В клетках проксимального канальца ион H+, образующийся при расщеплении воды на Н+ и ОН–, секретируется в просвет канальца (весьма вероятно, в обмен на Na+). Ион ОН– под действием карбоангидразы соединяется с СО2, образуя НСО3–, диффузирующий через мембрану перитубулярных клеток, проникая во внеклеточный пул НСО3–. Ион Н+ секретированный в просвет канальца, соединяется с отфильтрованным НСО3– образуя Н2СО3. Гипогидратация последнего соединения в просвете проксимального канальца приводит к образованию СО2, который также диффундирует из просвета в перитубулярную кровь. В результате этого отфильтрованный ион НСО3– утилизируется. Секретированные ионы Н+ имеют возможность соединяться также с некарбонатными буферами (например, с фосфатным), в канальцевой жидкости экскретируются в таких формах в дифинитивную мочу. Ион НСО3– — еще один начальный продукт распада H2CO3, образованный в клетках канальцев, проникает в перитубулярную кровь и регенерируется.
Ионы Н+ в моче связаны главным образом с отфильтрованными буферами (так называемая титрующаяся кислота) в количестве, эквивалентном количеству щелочи, необходимому для титрования рН мочи до величины рН крови. Однако обычно оказывается невозможным экскретировать все суточное количество кислот только в виде титрующейся кислоты. Для действия в качестве дополнительного буфера клетки почечных канальцев генерируют аммиак (NH3), главным образом в результате гидролиза глутамина. NH3 диффундирует из этих клеток в просвет канальца, где он соединяется с Н+, образуя NH4+. Как было отмечено ранее, экскреция в мочу каждого моля NH4+ сопровождается регенерацией 1 моля НСО3–. Аммиакогенез — процесс, происходящий в клетках проксимального канальца; обеспечивает быстрый отклик на нарушения кислотно-основного равновесия в организме человека. При возникновении острого избытка кислот и увеличенной потребности в регенерации НСО3– скорость синтеза аммиака в почках резко возрастет. Количество ионов Н+, экскретированного в виде титрующейся кислоты и NH4+, равно количеству ионов НСО3–, регенерированных в клетках канальцев и присоединившихся к плазме крови. При стабильном состоянии суммарное количество кислоты, экскретированной в мочу (сумма титрующейся кислоты и NH4+ минус НСО3–), должно быть равно количеству кислоты, поступившей во внеклеточную жидкость из всех источников. В случае нарушения этого хрупкого баланса развиваются метаболический ацидоз и алкалоз, причем первый является результатом недостаточной суммарной экскреции кислоты, а второй — результатом ее избыточной экскреции.
Прогрессирующая утрата функции почек обычно вызывает лишь незначительные (или совсем не вызывает) изменения в величинах рН артериальной крови, концентрации бикарбоната в плазме крови или парциального давления двуокиси углерода (Рсо2) в артериальной крови до тех пор, пока величина СКФ не опустится ниже 50% от ее нормального уровня. После этого три эти показателя уменьшаются по мере того, как развивается метаболический ацидоз. Обычно метаболический ацидоз при ХПН является не следствием гиперпродуцирования эндогенных кислот, а главным образом опережением снижения массы почек, вследствие чего ограничивается количество NH3 (и, следовательно, НСО3–), которое может быть генерировано. Хотя оставшиеся сохранными нефроны, вероятно, способны генерировать сверхнормальные количества NH3, приходящиеся на один нефрон, уменьшение числа нефронов приводит к снижению общего количества продуцируемой NH3 до такого уровня, при котором становится невозможным адекватное буферное взаимодействие ионов Н+ в моче. Хотя у больных с ХПН моча может иметь рН 4,5, дефицит образования NН3 ограничивает суммарную суточную экскрецию кислоты величиной в 1/2—2/3 количества нелетучих кислот, образованных в тот же отрезок времени. Неминуемым результатом этого положительного баланса Н+ является развитие метаболического ацидоза, который у большинства больных со стабильной ХПН носит относительно слабый и непрогрессирующий характер (рН артериальной крови составляет приблизительно 7,33—7,37).
При условии, что происходит существенное суточное накопление H+, а развившийся в результате этого ацидоз носит типично стабильный и непрогрессирующий характер, включая наблюдаемое относительное постоянство концентрации НСО3– в плазме крови (хотя и при сниженных уровнях ее содержания, соответствующих 14—20 мэкв/л), ясно, что стабильность ацидоза при ХПН должна обеспечиваться каким-то крупным тканевым источником буферного действия. Вероятнее всего, таким источником служит костная ткань, особенно если учесть большой резерв у нее щелочных солей (фосфат кальция и карбонат кальция). Растворение этого буферного источника, вероятно, вносит свой вклад в развитие нефрогенной остеопатии при ХПН (см. рис. 220-1).
Хотя развивающийся при ХПН ацидоз является следствием снижения суммарной массы почек и поэтому его можно рассматривать как канальцевый, тем не менее он в значительной степени зависит от СКФ. В случае, если СКФ снижена лишь умеренно (т. е. приблизительно до величины, составляющей 50% от ее нормального уровня), накопление анионов (главным образом сульфатов и фосфатов) не будет резко выраженным, так что по мере падения уровня содержания НСО3– в плазме крови из-за нарушения функции канальцев задержка Сl– почками будет приводить к развитию гиперхлоремического ацидоза. Поэтому в этой стадии анионный разрыв будет иметь нормальное значение. Однако при дальнейшем снижении СКФ и развитии более выраженной азотемии, как правило, будет происходит задержка фосфатов, сульфатов и других неизмеряемых анионов и концентрация Сl– в плазме крови снизится до нормальных уровней, несмотря на уменьшение в ней концентрации НСО3–. Вследствие этого развивается умеренный или большой анионный разрыв.
Канальцевый транспорт калия при нормальной и сниженной массе нефронов. Так же как концентрация H+, концентрация К+ во внеклеточной жидкости в норме поддерживается в относительно узком диапазоне — от 4 до 5 ммоль/л. Около 95% общего количества содержащегося в организме К+ находится во внутриклеточной жидкости, внутриклеточная концентрация К+ составляет приблизительно 160 ммоль/л. У здорового человека наружный баланс калия поддерживается суточной экскрецией в мочу такого количества К+, которое равно его количеству, поступающему с пищей, за вычетом относительно небольших количеств, теряемых с калом и потом. К+ легко фильтруется в клубочках, хотя экскретированная доля калия обычно составляет не более 20% от его отфильтрованного количества. Большая доля отфильтрованного количества К+ реабсорбируется в начальных отделах нефрона — приблизительно 65% в проксимальном канальце и еще 20—25% в петле нефрона. Процесс секретирова-ния К+ происходит в дистальном канальце и конечных отделах нефрона. Этот процесс зависит главным образом от обмена К+ и Na+ (реабсорбированный Na+), создающего электрический градиент поперек стенки канальца, в просвете которого сохраняется отрицательный заряд. Поэтому К+ диффундирует из внутриклеточного пространства в просветы дистальных канальцев и собирающих протоков в направлении этого электрохимического градиента.
Способность почек поддерживать наружный баланс К+ и сохранять нормальную его концентрацию в плазме крови вплоть до развития относительно поздних стадий ХПН является результатом главным образом прогрессирующего увеличения фракционной экскреции К+. По-видимому, в основе этой адаптации лежит сильное увеличение скоростей секретирования К+ в дистальных отделах оставшихся сохранными канальцев. Полагают, что в увеличение канальцевого секретирования K+ вносит свой вклад повышенная скорость секреции альдостерона и повышенные скорости тока в дистальных канальцах оставшихся сохранными нефронов, что обусловлено осмотическим диурезом и повышенным отрицательным электрическим зарядом в просвете канальца, возникающим в результате повышения концентрации таких анионов, как фосфаты и сульфаты, способных лишь в незначительной степени проникать через стенки канальца. Альдостерон также стимулирует поступление К+ в просвет ободочной кишки; как известно, этот механизм усиливается при ХПН. Более детально нарушения гомеостаза К+ при острой и хронической формах почечной недостаточности рассмотрены в гл. 219 и 220.
Дата добавления: 2015-03-17; просмотров: 951;
