ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ. Острая почечная недостаточность в общих чертах определяется как резкое ухудшение функции почек, в результате чего происходит накопление отходов азотного
Острая почечная недостаточность в общих чертах определяется как резкое ухудшение функции почек, в результате чего происходит накопление отходов азотного обмена в организме. Острая почечная недостаточность развивается приблизительно у 5% всех госпитализированных больных. К числу причин такого ухуд шения функции почек относятся гипоперфузия почек, обструктивная уропатия и заболевание собственно почек, как, например, поражение сосудов, клубочков и интерстиция, а также острый некроз канальцев. Однако не у всех этих больных некроз канальцев подтверждается гистологическими данными. Многие клиницисты используют термины «острая почечная недостаточность» и «острый некроз канальцев» как взаимозаменяемые для обозначения клинического синдрома обратимого острого заболевания собственно почек в отсутствие поражения почечных сосудов, клубочков и интерстиция.
Этиология. Около 60% всех случаев развития острой почечной недостаточности связаны с хирургическими вмешательствами или травмой. В 40% случаев острая почечная недостаточность у больного развивается при лечении в медицинских учреждениях и 1—2% — у женщин в период беременности. Однако чаще всего острая почечная недостаточность развивается как следствие ишемии почек. К числу клинических состояний, обусловливающих ишемию почек, относят тяжелое кровотечение, значительное уменьшение объема циркулирующей крови, интраоперационную гипотензию, кардиогенный шок и оперативные вмешательства, связанные с нарушением кровоснабжения почек. Острая почечная недостаточность развивается в случае длительной ишемии почек. Если уменьшение кровоснабжения кратковременно, то коррекция этого состояния способствует восстановлению функции почек (т. е. преренальная азотемия). Более продолжительная гипоперфузия почек вызывает острый некроз канальцев. Недавно проведенные исследования позволяют предположить, что подавление сосудорасширяющего действия почечных проста гландинов в результате использования нестероидных противовоспалительных средств стимулирует развитие ишемии почек. Таким образом, использование этих лекарственных средств для лечения больных со сниженным базальным уровнем почечного кровотока (сердечная недостаточность, цирроз печени, нефротический синдром, гломерулонефрит, гипоальбуминемия) может ускорить развитие острой почечной недостаточности.
Часто причиной острой почечной недостаточности служат нефротоксичные вещества. В прошлом развитие острой почечной недостаточности часто стимулировалось тяжелыми металлами, органическими растворителями и гликоля-ми. То, что в настоящее время эти токсины встречаются реже, не умаляет важности выяснения анамнеза у каждого больного с острой почечной недостаточностью о токсическом воздействии этих веществ в условиях профессиональной деятельности или в быту. Более поздние исследования позволяют предположить, что антибиотики из группы аминогликозидов и рентгеноконтрастные вещества также представляют собой одну из ведущих причин развития острой почечной недостаточности. Например, острая почечная недостаточность развивается у 10— 20% больных, получающих курс лечения аминогликозидами. Тяжесть протекания острой почечной недостаточности, связанной с действием этих лекарственных средств, усиливают такие факторы, как уменьшение объема внутрисосудистой жидкости, старческий возраст, наличие скрытого заболевания почек, истощение запасов калия в организме и сопутствующее применение других нефротоксичных веществ или сильнодействующих диуретиков. Рентгеноконтрастные вещества оказывают слабое нефротоксическое действие на здоровых людей. Однако у лиц, страдающих скрытым заболеванием почек, особенно у больных с диабетической нефропатией, введение рентгеноконтрастных веществ в 10—40% случаев вызывает развитие острой почечной недостаточности. Некоторые обезболивающие лекарственные средства (метоксифлуран и энфлуран) также могут вызывать развитие острой почечной недостаточности.
В настоящее время одной из причин почечной недостаточности считают выброс в кровь больших количеств миоглобина. Рабдомиолиз и миоглобинурия часто бывают обусловлены обширной травмой, сопровождающейся раздавливанием тканей. Однако нетравматический рабдомиолиз, связанный с повышенным потреблением кислорода мышцами (тепловой удар, тяжелая физическая нагрузка и припадки), снижением выработки энергии в мышцах (гипокалиемия, гипофосфатемия и генетически обусловленный дефицит ферментов), ишемией мышц (артериальная недостаточность, передозировка лекарственных средств, вызвавшая развитие комы, и компрессия мышц), инфекционными болезнями (грипп, болезнь «легионеров») и прямым действием токсинов (алкоголь), также может приводить к развитию острой почечной недостаточности. В связи с этим особое значение приобретает выявление у больных с острой почечной недостаточностью каких-либо симптомов со стороны мышц (болезненность, опухание, некроз мышц). Точный механизм, посредством которого миоглобинурия приводит к развитию острой почечной недостаточности, не выяснен. Существуют убедительные данные, свидетельствующие о том, что миоглобин не оказывает прямого нефротоксического действия. Однако были высказаны предположения о прямом нефротоксическом действии других продуктов распада мышечной ткани, а также о возможной обструкции канальцев, обусловленной преципитацией миоглобина и образованием цилиндров. У большинства лиц, страдающих связанной с рабдомиолизом острой почечной недостаточностью, отмечают также снижение объема внутрисосудистой жидкости и гипоперфузию почек.
Причиной острой почечной недостаточности служит также внутрисосудистый гемолиз. Хотя гемоглобин сам по себе не является сильным нефроток-сином, сочетанное действие токсичных веществ из стромы эритроцитов и гипоперфузия почек индуцируют развитие острой почечной недостаточности. И, наконец, в ряде случаев четкую этиологию острой почечной недостаточности установить не удается. Часто это нарушение развивается как результат совместного действия нескольких факторов (состояние шока, снижение объема внутрисосудистой жидкости, переливание крови, сепсис и лечение нефротоксичными антибиотиками).
Патофизиология (рис. 219-1). Современные теории патогенеза острой почечной недостаточности были разработаны главным образом на основании результатов экспериментов на животных. Существуют две точки зрения на механизм ее развития: поражение канальцев и поражение сосудов. В одной из канальцевых теорий предполагается, что цилиндры и осколки клеток закупоривают просвет канальцев, вызывая увеличение внутриканальцевого давления до величины, приводящей к снижению полного давления фильтрации. С другой стороны, некоторые исследователи полагают, что за развитие азотемии при острой почечной недостаточности ответствен «обратный ток» клубочкового фильтрата через поврежденный эпителий почечных канальцев. Авторы теории об основной роли сосудов в развитии острой почечной недостаточности предполагают, что выраженное снижение перфузионного почечного давления, сильный спазм афферентных артериол или вазодилатация эфферентных артериол приводят к снижению тока плазмы через клубочки, в результате чего гидростатическое давление понижается до уровня, достаточного для ослабления клубочковой фильтрации. Некоторые из авторов этой теории пришли к выводу, что для многих случаев острой почечной недостаточности может оказаться предпочтительнее термин вазомоторная нефропатия. Авторы другой теории патогенеза острой почечной недостаточности предполагают, что за развитие этого заболевания ответственны изменения проницаемости стенки почечного капилляра. Хотя в настоящее время не существует точной схемы патогенеза острой почечной недостаточности, можно считать вероятным, что причиной ее развития является взаимодействие событий, происходящих в канальцах и сосудах. Например, ишемия вызывает снижение давления в капиллярах клубочков, что предрасполагает к замедлению тока через канальцы. Ишемический некроз клеток с высвобождением апикальной мембраны в просвет канальца приводит к выпадению в осадок осколков клеток и в конечном итоге к вторичной обструкции канальца. Однако для установления относительной значимости каждого из факторов и определения механизмов, способствующих началу (ранняя стадия) и поддержанию (поздняя стадия) острой почечной недостаточности необходимы дополнительные исследования.
Патология. Изменения, наблюдаемые в почках больных с острой почечной недостаточностью, различны. Световая микроскопия позволяет выявить лишь явные изменения. Это могут быть различные степени некроза канальцев с поврежденным, некротическим или регенерирующим эпителием канальцев, внутриканальцевые цилиндры, интерстициальный отек -и интерстициальная клеточная инфильтрация; коллапс канальцев или их расширение. Если у больного не наблюдают диссеминированной внутрисосудистой коагуляции или тяжелого, длительного ишемического воздействия, то при световой и электронной микроскопии не выявляют повреждений внутрипочечных кровеносных сосудов и почечных клубочков. Гистологическими исследованиями установлено существование двух основных типов поражений почек. В результате прямого нефротоксического действия наблюдается однородный, диффузный некроз клеток извитых и прямых проксимальных канальцев. Базальная мембрана канальцев остается неповрежденной. Напротив, ишемия почек приводит к развитию слабого, пятнистого некроза по всему нефрону, наиболее выраженному в тех отделах канальцев, которые находятся на границе коры и мозгового вещества. Особенно ранимыми являются юкстамедуллярный прямой проксимальный каналец и толстая восходящая часть петли нефрона, находящаяся в мозговом веществе. Наблюдается также разрыв базальной мембраны канальцев. Несмотря на эти гистологические различия, клиническое течение нефротоксической и ишемической острой почечной недостаточности сходно. Строгой корреляции между гистопатологическими изменениями в почках и их функциональными параметрами при острой почечной недостаточности часто нет. Исследования биоптата почек, проведенные после выздоровления больного, выявляют лишь незначительные изменения или дают нормальные результаты.
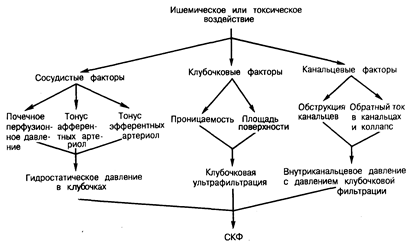
Рис. 219-1. Возможная схема патогенеза острой почечной недостаточности.
Дифференциальная диагностика (см. табл. 219-1). Диагноз острой почечной недостаточности ставят методом исключения, поскольку любое из преренальных (гипоперфузия почек), постренальных (непроходимость мочевых путей) и других внутрипочечных нарушений (гломерулонефрит, поражение сосудов и интерстициальной ткани почек) может вызвать развитие идентичного клинического синдрома нарушения функции почек. Однако в отличие от острой почечной недостаточности, преренальные, постренальные и другие внутрипочечные повреждения клубочков или сосудов поддаются специфической коррекции.
Нарушение перфузии почек, развившееся в результате внепочечных причин, может привести к такому снижению уровня клубочковой фильтрации, при котором будет невозможно обеспечить экскрецию суточного количества эндогенных продуктов азотного обмена. Азотемия может оказаться обратимой, если будет устранена причина почечной ишемии. Для этого может потребоваться увеличить объем внеклеточной жидкости, минутный объем сердца или восстановить нормальное почечное перфузионное давление. В таком случае для постановки диагноза необходимо провести сбор данных анамнеза, установить возможное снижение массы тела и объема внеклеточной жидкости или ее секвестрации, а также выявить симптомы нарушения минутного объема сердца у больных с нарушенной функцией почек. Кроме того, следует тщательно обследовать больного, причем особое внимание надо уделить выявлению ортостатической гипотензии и тахикардии, определить давление в яремных венах, тургор кожи, исследовать состояние слизистых оболочек и функцию сердца.
Таблица 219-1. Основные причины развития острой почечной недостаточности
| Нарушение | Пример |
| Преренальная недостаточность | |
| Гиповолемия | Уменьшение объема крови, притекающей к коже, пищеварительному тракту или почкам; кровотечение; секвестрация внеклеточной жидкости (ожоги, панкреатит, перитонит) |
| Сердечно-сосудистая недостаточность | Нарушение минутного объема сердца (инфаркт, тампонада); задержка крови в сосудах (анафилаксия, сепсис, лекарственные средства) |
| Постренальная недостаточность | |
| Внепочечная обструкция | Окклюзия мочеиспускательного канала, опухоли мочевого пузыря, тазовых органов, предстательной железы или забрюшинного пространства; простатизм; несчастный случай при хирургической операции; действие лекарственных средств; камни; гной; кровяные тромбы |
| Внутрипочечная обструкция | Кристаллы (мочевая кислота, щавелевая кислота, сульфаниламиды, метотрексат) |
| Разрыв мочевого пузыря | Травма |
| Специфические болезни почек | |
| Болезни сосудов | Васкулит; злокачественная гипертензия; болезнь Мошковича; склеродермия; артериальная и/или венозная окклюзия |
| Гломерулонефрит | Болезнь иммунных комплексов; поражение клубочковой базальной мембраны |
| Интерстициальный нефрит | Лекарственные средства; гиперкальциемия; инфекционные болезни; идиопатический |
| Острый некроз канальцев | |
| Постишемический | Все состояния, перечисленные выше для преренальной недостаточности |
| Пигментиндуцированный | Гемолиз (реакция на переливание крови, малярия); рабдомиолиз (травма, поражение мышц, кома, инфаркт сердца, тяжелая физическая нагрузка, истощение запасов калия или фосфора) |
| Токсининдуцированный | Антибиотики; рентгеноконтрастные средства; обезболивающие средства; тяжелые металлы; органические растворители |
| Связанный с беременностью | Септический аборт; маточное кровотечение; эклампсия |
Следует принимать во внимание возможность закупорки мочевых путей, что встречается у 1—10% больных с прогрессирующим снижением функции почек и часто бывает обратимым. Задержка мочи, происходящая в результате анатомической (поражение предстательной железы) или функциональной (органическая или индуцированная лекарственными средствами нефропатия) обструкции шейки мочевого пузыря, представляет собой сравнительно частую причину почечной недостаточности, и ее можно определить посредством пальпации надлобковой области и перкуссии или единичной катетеризации мочевого пузыря для определения объема остаточной мочи. Обструкция верхних отделов мочевых путей является более редкой причиной почечной недостаточности, поскольку для ее развития требуется одновременная обструкция обоих мочеточников или односторонняя обструкция мочеточника в случае, когда вторая почка отсутствует или подверглась тяжелому поражению. К числу причин двусторонней обструкции мочевых путей относятся болезнь Ормонда, опухоли, абсцессы, несчастный случай во время хирургической операции и двусторонняя окклюзия мочеточников (камни, ткань сосочков, кровяные тромбы или гной). Выявить постобструкционную почечную недостаточность помогут тщательное ректальное исследование и обследование тазовых органов. Обзорная рентгенограмма брюшной полости выявит процессы, локализующиеся в забрюшинном пространстве, или рентгеноконтрастные конкременты. Если обструкция верхних отделов мочевых путей не может быть исключена с помощью ультразвукового исследования, то дополнительную информацию дадут инфузионная урография, компьютерная томография или исследование проходимости мочеточников посредством ретроградной пиелографии. Нарушение тока мочи может произойти и в самих почках. Такая внутрипочечная обструкция обычно бывает обусловлена осаждением в просвете канальцев плохо растворимых веществ, таких как мочевая кислота (химиотерапия опухолей), щавелевая кислота (передозировка этиленгликоля, обезболивание при помощи метоксифлурана, анастомоз тонкой кишки), метотрексат (нерастворимые метаболиты), сульфаниламиды (с истекшим сроком годности, нерастворимые соединения пролонгированного действия) и, возможно, миеломные белки.
После того как пре- и постренальные нарушения будут исключены, целесообразно рассмотреть вопрос о возможности поражения сосудов почек — развития гломерулонефрита и интерстициального нефрита (см. табл. 219-1). Как часто эти болезни окажутся причиной прогрессирующего снижения функции почек, зависит от возраста больного. У взрослых только 5—10% всех случаев прогрессирующего снижения функции почек можно отнести на их счет, в то время как у детей эти болезни могут быть причиной подобного снижения в 40—60% случаев. Хотя эти болезни встречаются реже, чем острый некроз канальцев, часто они поддаются специфической коррекции, и их следует принимать во внимание в каждом случае снижения функции почек.
При первом осмотре больного терминальную стадию хронической почечной недостаточности можно ошибочно принять за острую почечную недостаточность. Чтобы избежать этого, врач должен иметь анамнез болезни пациента. Так, нефрогенная остеопатия, уремическая невропатия, маленький размер почек на рентгенограммах брюшной полости и необъяснимая анемия заставляют предположить наличие хронической почечной недостаточности. Однако при некоторых, характерных для терминальной стадии хронической почечной недостаточности заболеваниях, таких как амилоидоз, поликистоз почек, диабетический гломерулосклероз, склеродермия и быстропрогрессирующий гломерулонефрит, размеры почек могут быть нормальными или даже увеличенными, что потребует времени для длительного наблюдения за больным, а иногда и проведения биопсийного исследования почек, чтобы отличить потенциально обратимые формы острой почечной недостаточности от терминальной стадии хронической почечной недостаточности.
Наблюдение за особенностями тока мочи может помочь установить причины прогрессирующего снижения функции почек. Полная анурия (отсутствие мочи при катетеризации) редко наблюдается при остром некрозе канальцев. К числу возможных причин полной анурии относятся полная двусторонняя обструкция мочеточников, диффузный некроз коры почек, быстропрогрессирующий гломерулонефрит и двусторонняя окклюзия почечных артерий. Значительные колебания в суточных количествах мочи заставляют предположить наличие интермиттирующей обструктивной уропатии. Полиурия (более 3 л мочи в сутки) может быть признаком частичной обструкции мочевых путей. Полиурия является вторичной по отношению к сопутствующему нарушению концентрационной способности почек. Хотя олигурия (менее 400 мл мочи в сутки) считается основным признаком острой почечной недостаточности, у многих таких больных объем выделяемой мочи превышает 1 л в сутки. Такая ситуация получила название неолигурической острой почечной недостаточности.
Исследование осадка мочи представляет большую ценность при дифференциальной диагностике острых нарушений функции почек. Осадок, содержащий мало форменных элементов крови или только гиалиновые цилиндры, позволяет определенно предположить наличие преренальной азотемии или обструктивной уропатии. При остром некрозе канальцев более чем у 75% больных в осадке мочи наблюдаются коричневатые пигментированные клеточные цилиндры и большое число эпителиальных клеток почечных канальцев. Эритроцитарные цилиндры в осадке мочи наводят на мысль о наличии воспалительных процессов клубочков или сосудов почек, но они редко (или вообще никогда) присутствуют в осадке мочи при остром некрозе канальцев. Обнаружение большого числа полиморфно-ядерных лейкоцитов в виде одиночных клеток или их агрегатов позволяет предположить наличие острого диффузного интерстициального нефрита или некроза сосочков. Выявление эозинофильных цилиндров при окрашивании осадка мочи по Hansel помогает диагностировать острый аллергический интерстициальный нефрит. Сочетание коричневатых пигментированных зернистых цилиндров в осадке мочи и положительных результатов теста на наличие скрытой крови в моче в отсутствие гематурии указывает на гемоглобинурию, миоглобинурию. При острой почечной недостаточности выявление в свежей, теплой моче большого числа кристаллов мочевой кислоты позволяет предположить диагноз острой нефропатии, вызванной мочевой кислотой, в то время как присутствие большого числа кристаллов щавелевой или гиппуровой кислот наводит на мысль о токсическом действии этиленгликоля. Наличие большого числа широких цилиндров (диаметр которых превышает толщину 2—3 лейкоцитов) заставляет предположить диагноз хронической почечной недостаточности. Химический анализ состава мочи тоже может помочь отличить острый некроз канальцев от преренальной азотемии у больных, страдающих олигурией; результаты такого анализа представлены в табл. 219-2. Важно вспомнить о том, что при других заболеваниях, связанных с внезапным нарушением функции почек при сохранности почечных канальцев, таких как гломерулонефрит и ранняя фаза (несколько первых часов) обструктивной уропатии, химический состав мочи аналогичен таковому при преренальной азотемии. До введения мочегонных средств осмотический диурез, обусловленный гликозурией, бикарбонатурией и кетонурией, может помешать активной реабсорбции натрия и воды в почечных канальцах и тем самым изменить показатели химического состава мочи. Соотношение концентраций мочевой кислоты и креатинина, превышающее 1, может говорить и о том, что причиной острой почечной недостаточности является вызванная мочевой кислотой острая нефропатия.
Таблица 219-2. Данные химического анализа мочи при преренальной азотемии и острой почечной недостаточности
| Лабораторное исследование | Преренальная азотемия | Острая почечная недостаточность |
| Осмоляльность мочи (мосм/кг) | >500 | <400 |
| Содержание натрия в моче (ммоль/л) | <20 | >40 |
| Соотношение концентраций креатинина в моче и в плазме крови | >40 | <20 |
| Фракционная экскреция1 отфильтрованного натрия | <1 | |
| Осадок мочи | Обычный или содержащий гиалиновые и зернистые цилиндры | Коричневые зернистые цилиндры, обломки клеток |
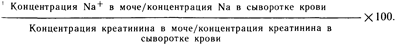
Иногда причина прогрессирующего снижения функции почек неочевидна. В других случаях у больного отмечаются признаки, которые не считаются типичными для острого некроза канальцев (постепенное.начало почечной недостаточности; анурия в отсутствие обструктивной уропатии; выраженная гипертензия, протеинурия в тяжелой степени; значительная гематурия, скрытое системное заболевание и длительная олигурия). Поскольку подобные атипичные признаки могут указывать на потенциально излечимые формы поражения паренхимы почек, например, на врожденный сифилитический остеохондрит Вегенера, системную красную волчанку, синдром Гудпасчера или быстропрогрессирующий гломерулонефрит, то в тех случаях, когда причина почечной недостаточности неясна или имеются такие атипичные признаки, целесообразно провести диагностическое биопсийное исследование почек.
Клиническое течение. Клиническое течение при остром некрозе канальцев можно разделить на инициирующую фазу, фазу поддержания и фазу восстановления. Инициирующая фаза — это период времени между воздействием причинного фактора и проявлением острой почечной недостаточности, которую уже нельзя устранить при помощи изменения внепочечных факторов. Признание существования инициирующей фазы острой почечной недостаточности чрезвычайно важно, поскольку теоретически ранняя коррекция скрытой причины почечной недостаточности может предотвратить развитие фазы поддержания. Однако для клиницистов существование инициирующей фазы острой почечной недостаточности может стать очевидным только при ретроспективном анализе процесса, поскольку у них нет характерных признаков и симптомов.
Олигурия считалась главным отличительным признаком инициирующей и поддерживающей фаз острой почечной недостаточности. Однако проведенные в последнее время исследования заставляют предположить, что у 40—50% больных с острой почечной недостаточностью олигурия отсутствует (объем мочи более 400 мл/сут). Хотя протекающая без олигурии прогрессирующая острая почечная недостаточность может быть результатом поражения почек любого типа, включая как ишемическое, так и токсическое, однако эта форма острой почечной недостаточности, по-видимому, особенно часто развивается после нефротоксического воздействия лекарственных средств (например, аминогликозида). Прогрессирующая азотемия развивается у не страдающих олигурией больных в результате значительного снижения скорости клубочковой фильтрации и концентрационной способности почек. Например, максимальная осмоляльность мочи у не страдающих олигурией больных в среднем составляет только 350 моем на 1 кг воды. Следовательно, при выделении 1000 мл мочи в сутки может быть экскретировано ежесуточно не более 350 моем растворенных веществ. При острой почечной недостаточности суточная солевая нагрузка может увеличиться от нормальных значений в 600 моем до величины, превышающей 1000 моем. Таким образом, несмотря на суточное выделение 1 л мочи, у больного разовьются положительный солевой баланс (преимущественно мочевины и креатинина) и азотемия.
Олигурия служит характерным признаком фазы поддержания острой почечной недостаточности более чем в 50% случаев. Развивается олигурия вскоре после стимулирующего воздействия и длится в среднем 10—14 сут. Однако продолжительность олигурической фазы может быть как короче — всего несколько часов, так и длиннее — от 6 до 8 нед. Длительная олигурия обычно наблюдается у больных пожилого возраста, страдающих скрытым заболеванием сосудов. Если олигурия длится дольше 4 нед, то следует пересмотреть диагноз острого некроза канальцев и, возможно, допустить существование таких нарушений, как диффузный некроз коры почек, быстропрогрессирующий гломерулонефрит, окклюзия почечной артерии, почечный васкулит и сопутствующее снижение объема внеклеточной жидкости. Анурия нехарактерна для острого некроза канальцев. Однако тяжелая степень олигурии, продолжающейся в течение нескольких дней и характеризующейся объемом мочи менее 100 мл/сут, может быть обусловлена острым некрозом канальцев.
В инициирующей и поддерживающей фазах острой почечной недостаточности нарушается выведение из организма с мочой продуктов азотного обмена, воды, электролитов и кислот. Выраженность изменений, происходящих при этом в химическом составе крови, зависит от наличия олигурии, состояния катаболизма у больного. У не страдающих олигурией больных отмечают более высокие уровни клубочковой фильтрации, чем у больных с олигурией, и вследствие этого у первых с мочой экскретируется больше продуктов азотного обмена, воды и электролитов. Поэтому нарушения химического состава крови при острой почечной недостаточности у не страдающих олигурией больных обычно бывают слабее выражены, чем у страдающих олигурией.
У нелихорадящих, некатаболизирующих больных с олигурией при острой почечной недостаточности суточное увеличение концентрации азота мочевины в крови (АМК) и уровня содержания креатинина в сыворотке крови составляет в среднем соответственно 100—200 и 5—1 мг/л. У катаболизирующих больных, страдающих лихорадкой, сепсисом или обширной травмой, эти показатели могут достигать значений соответственно 400—1000 и 20—50 мг/л. У больных с острой почечной недостаточностью, обусловленной рабдомиолизом, суточное увеличение уровня содержания креатинина в сыворотке крови может быть непропорционально высоким по сравнению с увеличением концентрации АМК. Это обусловлено высвобождением из мышц креатина, который путем неферментного гидролиза превращается в креатинин.
Больные, страдающие острой почечной недостаточностью, сопровождающейся олигурией, составляют группу повышенного риска развития солевой и водной сверхнагрузки, приводящей к гипонатриемии, отеку и застою крови в легких. Гипонатриемия является следствием поступления в организм чрезмерного количества воды, а отек — чрезмерных количеств и воды, и натрия. Если не возмещать происходящих потерь воды с мочой у больных, не страдающих олигурией и обладающих сравнительно высокой скоростью тока мочи и концентрацией натрия в моче, то у них возможно резкое уменьшение объема внутрисосудистой жидкости, способное задержать восстановление функции почек.
Для острой почечной недостаточности характерна гиперкалиемия, обусловленная сниженной элиминацией калия почками при продолжающемся высвобождении его из тканей. Обычное суточное увеличение концентрации калия в сыворотке крови у не страдающих олигурией и подверженных катаболизму больных составляет 0,3—0,5 ммоль/сут. Большее суточное увеличение концентрации калия в сыворотке крови говорит о возможной эндогенной (деструкция тканей, гемолиз) или экзогенной (лекарственные средства, пищевой рацион, переливание крови) калиевой нагрузке или о высвобождении калия из клеток вследствие ацидемии. Обычно гиперкалиемия протекает бессимптомно до тех пор, пока концентрация калия в сыворотке крови не возрастает до значений, превышающих 6,0—6,5 ммоль/л. В случае превышения этого уровня наблюдаются изменения на электрокардиограмме (брадикардия, отклонение электрической оси сердца влево, остроконечные зубцы Т, расширение желудочковых комплексов, увеличение интервала Р—R и снижение амплитуды зубцов Р) и в конечном итоге может произойти остановка сердца. Гиперкалиемия может также привести к развитию мышечной слабости и вялого тетрапареза.
При острой почечной недостаточности наблюдаются также гиперфосфатемия, гипокальциемия и слабая степень гипермагниемии. Гиперфосфатемия является результатом снижения элиминации фосфора почками при продолжающемся высвобождении его из тканей. Концентрация фосфора в сыворотке крови обычно находится в диапазоне 60—80 мг/л, но у больных с травмой, высоким уровнем катаболизма, как и у больных, страдающих рабдомиолизом, уровни содержания фосфора в сыворотке крови могут быть значительно выше. Причина гипокальциемии с содержанием кальция в сыворотке крови в пределах 60—90 мг/л неясна. Гипермагниемия часто протекает бессимптомно, содержание магния в сыворотке крови при этом увеличивается до 20—30 мг/л. Подобное незначительное увеличение концентрации магния в сыворотке крови наблюдается до тех пор, пока не начинают применять магнийсодержащие лекарственные средства, такие как антациды.
Метаболический ацидоз — постоянный спутник острой почечной недостаточности. Суточное количество продуцируемых в ходе эндогенных обменных процессов нелетучих кислот, составляющее приблизительно 1 мэкв на 1 кг массы тела, не может долее элиминироваться поврежденными почками. В результате этого органические кислоты накапливаются в организме в количестве, достаточном для того, чтобы вызывать суточное снижение концентрации бикарбоната в плазме крови на 0,5—1 ммоль и развитие метаболического ацидоза с образованием анионного разрыва.
При острой почечной недостаточности часто развивается гиперурикемия с содержанием мочевой кислоты в сыворотке крови 90—120 мг/л, обусловленная снижением экскреции мочевой кислоты почками. У больных с высокой степенью катаболизма и обширным повреждением тканей уровни содержания мочевой кислоты в сыворотке крови могут быть и выше. Увеличение концентрации амилазы в сыворотке крови, обусловленное нарушением экскреции ее почками, может наблюдаться даже в том случае, если нет клинических признаков панкреатита. Степень увеличения концентрации амилазы невелика, и обычно она соответствует превышению верхних пределов нормальных значений меньше чем в 2 раза.
При острой почечной недостаточности изменяются гематологические показатели. Вскоре после развития значительной азотемии развивается нормоцитарная, нормохромная анемия, а гематокритное число стабилизируется на уровне 20—30 объемных процентов. Анемия обусловлена ослаблением эритропоэза, а также некоторым уменьшением продолжительности жизни эритроцитов. К числу дополнительных факторов, вносящих свой вклад в развитие анемии, относятся гидремия, потеря крови через пищеварительный тракт и угнетение эритропоэза вследствие инфекционного заболевания или введения лекарственных средств. Продуцирование лейкоцитов не претерпевает серьезных изменений, однако поскольку острая почечная недостаточность развивается, как правило, в условиях стресса и повреждения тканей, то у больного наблюдается слабый лейкоцитоз. Если содержание лейкоцитов не нормализуется и после 1-й недели развития острой почечной недостаточности, это позволяет предположить наличие у пациентов инфекционного заболевания. В ранних стадиях острой почечной недостаточности может наблюдаться слабая степень тромбоцитопении, обусловленная снижением выработки тромбоцитов в костном мозге. Развиваются качественные нарушения функции тромбоцитов, которые в сочетании с дополнительными плохо выявляемыми нарушениями свертываемости крови вносят свой вклад в развитие тенденции к кровоточивости. Острая почечная недостаточность может развиться в результате внутрисосудистого гемолиза, а также быть осложнением нескольких первичных гематологических или сосудистых заболеваний, сопровождающихся такими серьезными явлениями, как диссеминированная внутрисосудистая коагуляция, тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром и системная красная волчанка.
Инфекционные болезни осложняют течение острой почечной недостаточности у 30—70% больных и рассматриваются как ведущая причина смертности. Воротами инфекции чаще служат дыхательные пути, места проведения хирургических операций и мочевые пути. При этом часто развивается септицемия, вызываемая как грамположительными, так и грамотрицательными микроорганизмами. Абсцессы, возникающие в местах выполнения хирургических операций (особенно в брюшной полости), обусловливают неблагоприятный прогноз в том случае, если они не будут своевременно выявлены, а больным не будет оказано соответствующего лечения. Хотя еще предстоит точно определить факторы, ответственные за высокую частоту развития инфекционных осложнений, определенную роль в их возникновении может играть нарушение целостности анатомических барьеров при внутривенных вливаниях и введении постоянных катетеров. Имеются также данные о нарушении при уремии защитных механизмов организма-хозяина, включая дисфункцию лейкоцитов. Особенно важно для больных с острой почечной недостаточностью свести к минимуму использование постоянных катетеров и линий для внутривенного вливания, проводить тщательный ежедневный осмотр и дать своевременную точную оценку причин развившейся лихорадки. Важно также подчеркнуть, что уремия может маскировать лихорадку, вызванную развитием инфекционного заболевания.
К числу сердечно-сосудистых осложнений острой почечной недостаточности относятся недостаточность кровообращения, гипертензия, аритмии и перикардит. Недостаточность кровообращения развивается в результате введения в организм чрезмерно больших количеств натрия и воды. Слабая гипертензия наблюдается у 15—25% больных и проявляется обычно через 7—9 дней после начала олигурии. Часто она служит проявлением чрезмерного увеличения объема внеклеточной жидкости; однако в некоторых случаях в развитие гипертензии может вносить вклад и повышение активности системы ренин—ангиотензин у 20—JU% больных. Острая почечная недостаточность осложняется наджелудочковыми аритмиями, к числу известных причин возникновения которых относятся застойная сердечная недостаточность, нарушение электролитного баланса, интоксикация препаратами наперстянки, перикардит и анемия. В настоящее время перикардит развивается редко, возможно, благодаря раннему применению диализной терапии.
Острая почечная недостаточность часто сопровождается неврологическими нарушениями. У больных, не находящихся на диализе, наблюдаются летаргия, сонливость, помутнение сознания, дезориентировка, «порхающее» дрожание, тревожное возбуждение, миоклонические подергивания мышц и судорожные припадки. В большей степени они характерны для больных пожилого возраста и хорошо поддаются коррекции при диализной терапии. Помимо собственно уремии, в качестве потенциальных причин неврологических нарушений у больного с острой почечной недостаточностью необходимо рассматривать такие факторы, как введение лекарственных средств, нарушение обмена веществ и электролитного баланса, а также наличие первичного неврологического заболевания.
Острой почечной недостаточности часто сопутствуют осложнения со стороны желудочно-кишечного тракта, к числу которых относятся анорексия, тошнота, рвота, непроходимость кишечника и неопределенные жалобы на дискомфорт в брюшной полости. Сочетание возникшего в результате острого заболевания стресса и гемостатических нарушений у 10—30% больных приводит к развитию незначительных и легко контролируемых с помощью консервативной терапии желудочно-кишечных кровотечений. Было показано, что внутривенное введение 1-деамино-8-аргинин-вазопрессина (ДАВП, внутривенно в дозе 0,4 мкг/кг) уменьшает время кровотечения и улучшает гемостаз у некоторых больных с острой почечной недостаточностью. В случае, если ДАВП неэффективен, целесообразно использовать криопреципитат.
Когда скорость клубочковой фильтрации увеличивается настолько, что прекращается дальнейшее увеличение концентрации АМК и содержания креатинина в сыворотке крови, говорят о начале фазы восстановления острой почечной недостаточности. При олигурической острой почечной недостаточности предвестником наступления фазы восстановления служит прогрессирующее увеличение объема выделяемой мочи. В первые дни объем выделяемой мочи увеличивается в 2 раза за сутки, а в некоторых случаях уже через несколько дней может быть достигнут суточный объем мочи, превосходящий 2 л. У не страдающих олигурией больных выраженной диуретической фазы обычно не наблюдается. Продолжительность фазы восстановления у тех больных, концентрация АМК и содержание креатинина в сыворотке крови которых превышают соответственно 500 и 50 мг/л, составляет в среднем 15—25 сут у страдающих олигурией больных и 5—10 сут у не страдающих олигурией. Основные осложнения острой почечной недостаточности, такие как инфекционные болезни, желудочно-кишечные кровотечения, нарушение баланса жидкости и электролитов и нарушение функции сердечно-сосудистой системы, могут быть стойкими или впервые проявиться во время фазы восстановления. Кроме того, существующие стойкие нарушения функции клубочков и канальцев могут привести во время этой фазы к развитию гипер- или гипогидратации или к нарушению баланса электролитов, если в этот период времени не будут осуществляться тщательное ежедневное определение массы тела больного, количества поступающей в организм и выделяемой жидкости, биохимическое и клиническое контролирование состояния больного. У больных с рабдомиолизом во время фазы восстановления может развиться гиперкальциемия, причина которой остается неясной. Хотя основное улучшение функции почек происходит в течение первых 1-2 нед фазы восстановления, дальнейшая ее нормализация продолжается в течение года после заболевания. Результаты чувствительных тестов функции клубочков и канальцев позволяют также предположить, что некоторые небольшие дефекты в функционировании почек могут сохраняться неопределенно долго после острого некроза канальцев. Однако у подавляющего большинства больных функция почек восстанавливается и не имеется свидетельств о развитии у них в дальнейшем какой-либо дисфункции органа или таких осложнений, как гипертензия.
Показатели смертности в больших группах больных с острой почечной недостаточностью варьируют в пределах от 30 до 60%. Наивысшие показатели смертности наблюдались у больных, перенесших хирургические операции или травмы (50—70%); промежуточные значения этих показателей имели место у больных, находящихся на лечении в медицинских учреждениях (30—50%), и самые низкие показатели смертности при острой почечной недостаточности были в акушерских стационарах (10—20%). Более высокие показатели смертности среди лиц пожилого возраста, больных с серьезными скрытыми заболеваниями и многочисленными осложнениями, у больных с острой почечной недостаточностью, не сопровождающейся олигурией, наблюдаются показатели заболеваемости и смертности, более низкие, чем у больных с олигурической острой почечной недостаточностью. Основными причинами смерти при острой почечной недостаточности служат инфекционные осложнения; осложнения, развивающиеся в результате нарушений баланса жидкости и электролитов; желудочно-кишечное кровотечение и прогрессирование первичного основного заболевания.
Лечение (табл. 219-3). Основой лечения больных с острой почечной недостаточностью является возможно более полное устранение причин ухудшения функции почек. Прежде всего необходимо выявить преренальные факторы, обструктивную уропатию, гломерулонефрит, поражения сосудов почек и интерстиция и внутрипочечно осажденные кристаллы. После того как методом исключения будет поставлен диагноз острого некроза канальцев, врач должен осознать, что существующие методы специфической терапии крайне немногочисленны. Выведение из организма нефротоксинов, таких как тетрахлорметан, этиленгликоль и тяжелые металлы, после комплексообразующей терапии осуществляют посредством диализа. Чрезвычайно важно устранить любые преренальные факторы как для улучшения кровообращения, так и для того, чтобы избежать задержки начала фазы восстановления. Больным с олигурией, у которых была проведена коррекция преренальных факторов, целесообразно назначать сильнодействующие мочегонные средства, местом действия которых является петля нефрона, или маннит, способствующий увеличению тока мочи. Если, несмотря на введение сильнодействующих мочегонных средств, олигурия сохраняется, больному показано внутривенное вливание малых доз дофамина (1—3 мг/кг в 1 мин), способствующего увеличению почечного кровотока. Это должно помочь почкам соответственно отреагировать на действие мочегонных средств. Подобное лечение основано на предположении о том, что существует ранняя фаза почечной недостаточности, во время которой коррекция преренальных факторов и поддержание тока мочи могут препятствовать развитию олигурии. Проспективные исследования показали, что для острой почечной недостаточности, протекающей без олигугии, характерны более низкие показатели заболеваемости и смертности, чем для олигурической формы. Однако, чтобы убедиться в целесообразности применения сильнодействующих мочегонных средств и дофамина в ранней стадии острой почечной недостаточности с целью переведения олигурической почечной недостаточности в неолигурическую, с сопутствующим снижением показателей заболеваемости и смертности, необходимы дальнейшие проспективные контролируемые исследования.
Таблица 219-3. Схема лечения больных с острой почечной недостаточностью
1. Устранить все причины снижения функции почек, поддающиеся специфической терапии, включая коррекцию преренальных и постренальных факторов
2. Попытаться добиться устойчивой величины объема выделяемой мочи
3. Консервативная терапия: а) уменьшить поступающие в организм количества азота, воды и электролитов в такой степени, чтобы они соответствовали их выводимым количествам; б) обеспечить адекватное питание больного; в) изменить характер медикаментозной терапии; г) обеспечить контроль за клиническим состоянием больного (частота измерений жизненно важных показателей определяется состоянием больного; измерение количеств поступающих в организм и выделяемых из него веществ; массы тела; осмотр ран и мест внутривенного вливания; физикальное обследование следует проводить ежедневно); д) обеспечить контроль биохимических показателей (частота определения концентраций АМК, креатинина, электролитов и подсчета формулы крови будет диктоваться состоянием больного; у страдающих олигурией и катаболизмом больных определять эти показатели следует ежедневно, концентрации фосфора, магния и мочевой кислоты — реже)
4. Выполнить диализную терапию
Ряд проявлений острой почечной недостаточности можно контролировать с помощью консервативной терапии. После того как будут устранены любые нарушения объема внутрисосудистой жидкости, количество поступающей в организм жидкости должно точно соответствовать сумме ее измеренного выводимого количества и неощутимых потерь. Количества вводимых в организм натрия и калия не должны превышать их измеренных выводимых количеств. Ежедневное контролирование баланса жидкости и массы тела дает возможность установить, не нарушен ли у больного нормальный объем внутрисосудистой жидкости. У больных с острой почечной недостаточностью, получающих адекватное лечение, масса тела снижается на 0,2—0,3 кг/сут. Более значительное уменьшение массы тела наводит на мысль о гиперкатаболизме или снижении объема внутрисосудистой жидкости, а менее значительное заставляет предположить, что в организм поступают избыточные количества натрия и воды. Поскольку большинство лекарственных средств выводится из организма, по меньшей мере частично, почками, то необходимо уделять пристальное внимание использованию лекарственных средств и их дозировке. Концентрация натрия в сыворотке крови служит ориентиром для определения требуемого количества вводимой воды. Снижение концентрации натрия указывает на то, что в организме имеется избыток воды, в то время как необычно высокая концентрация указывает на недостаток воды в организме.
С целью уменьшения катаболизма необходимо обеспечить ежесуточное поступление в организм по меньшей мере 100 г углеводов. В некоторых из недавно проведенных исследований утверждается, что при введении в центральные вены смеси аминокислот и гипертонического раствора глюкозы улучшается состояние больных и снижается смертность в группе больных, страдающих острой почечной недостаточностью, развившейся после хирургических операций или травмы. Поскольку парентеральное введение чрезмерно больших количеств питательных веществ может быть связано со значительными сложностями, этот вид питания следует зарезервировать для больных, подверженных катаболизму, у которых не удается получить удовлетворительных результатов при помощи обычного введения питательных веществ через рот. Ранее для уменьшения уровня катаболизма белков и снижения скорости увеличения АМК использовали анаболические андрогены. В настоящее время такое лечение не применяют. К числу дополнительных мер, снижающих уровень катаболизма, относятся своевременное удаление некротизированных тканей, контролирование гипертермии и раннее начало специфической антимикробной терапии.
Больным со слабой степенью метаболического ацидоза, связанного с острой почечной недостаточностью, лечение не назначают, за исключением лиц, у которых концентрация бикарбоната в сыворотке крови не снижается менее 10 мэкв/л. Попытка восстановить кислотно-основное состояние путем срочного введения щелочей может снизить концентрацию ионизированного кальция и спровоцировать развитие тетании. Гипокальциемия обычно протекает бессимптомно и редко требует специфической коррекции. Гиперфосфатемию следует контролировать при помощи перорального введения 30—60 мл гидроокиси алюминия 4—6 раз в сутки, поскольку при величине произведения кальций х фосфор более 70 развивается кальциноз мягких тканей. Своевременное начало диализной терапии поможет контролировать повышенную концентрацию фосфора в сыворотке крови больных с тяжелой формой гиперфосфатемии. Если у больного не выявили острой нефропатии, обусловленной мочевой кислотой, то вторичная гиперурикемия при острой почечной недостаточности чаще всего не требует применения аллопуринола. Снижение величины скорости клубочковой фильтрации делает долю отфильтрованной мочевой кислоты и, следовательно, отложение мочевой кислоты внутри канальцев незначительными. Кроме того, по неизвестным причинам острая почечная недостаточность, несмотря на гиперурикемию, редко осложняется клинически проявляющейся подагрой. Для своевременного выявления желудочно-кишечного кровотечения важно проводить тщательное наблюдение за изменениями гематокритного числа и наличием скрытой крови в кале. Если гематокритное число будет быстро снижаться и скорость этого снижения окажется неадекватной степени тяжести почечной недостаточности, то следует искать альтернативные причины анемии.
Застойная сердечная недостаточность и гипертензия служат индикатором наличия в организме избыточного количества жидкости и требуют принятия соответствующих мер. При этом необходимо помнить, что многие лекарственные средства, такие как дигоксин, экскретируются главным образом почками. Как отмечалось ранее, стойкая гипертензия не всегда обусловливается повышенным объемом жидкости в организме; в ее развитие могут вносить свой вклад такие факторы, как гиперренинемия. В ряде случаев в целях предотвращения желудочно-кишечных кровотечений у некоторых тяжелобольных успешно проводили селективную блокаду гистамин-2-рецепторов (циметидином, ранитидином), однако целесообразность такого лечения при острой почечной недостаточности пока не исследовалась. Чтобы избежать инфицирования и нарушения целостности анатомических барьеров, следует избегать длительной катетеризации мочевого пузыря, проводить санацию полости рта и кожи, места введения катетеров для внутривенных вливаний и места разреза кожи для выполнения трахеостомии обрабатывать с соблюдением правил асептики, а также осуществлять тщательное клиническое наблюдение. При повышении температуры тела у больного необходимо тщательно его обследовать, особое внимание обращая на состояние легких, мочевых путей, ран и мест введения катетера для внутривенного вливания.
При острой почечной недостаточности часто развивается гиперкалиемия. Если повышение концентрации калия в сыворотке крови небольшое (менее 6,0 ммоль/л), то для его корректировки достаточно лишь исключить из пищевого рациона все источники калия и вести постоянный тщательный лабораторный контроль биохимических показателей. Если концентрация калия в сыворотке крови возрастает до уровней, превышающих 6,5 ммоль/ и особенно если появятся какие-либо изменения на ЭКГ, то следует начать активное лечение больного. Лечение можно подразделить на неотложную и рутинную формы. Неотложное лечение включает в себя внутривенное введение кальция (5—10 мл 10% раствора хлорида кальция вводят внутривенно в течение 2 мин под контролем ЭКГ), бикарбоната (внутривенно вводят 44 мэкв в течение 5 мин) и глюкозы с инсулином (200—300 мл 20% раствора глюкозы, содержащего 20—30 ЕД обычного инсулина, вводят внутривенно в течение 30 мин). Рутинное лечение включает в себя введение калийсвязывающих ионнообменных смол, таких как полистирол сульфоната натрия. Их можно вводить перорально каждые 2—3 ч в дозе. 25—50 г со 100 мл 20% сорбита для профилактики запоров. С другой стороны, больному, который не может принимать лекарства через рот, можно вводить с интервалом 1—2 ч 50 г полистиролсульфоната натрия и 50 г сорбита в 200 мл воды посредством удерживающей клизмы. В случае развития рефрактерной гиперкалиемии может возникнуть необходимость в проведении гемодиализа.
Некоторых больных с острой почечной недостаточностью, особенно в случае отсутствия у них олигурии и катаболизма, можно успешно лечить, не применяя диализную терапию или при минимальном ее использовании. Существует все возрастающая тенденция использовать диализную терапию в ранних стадиях острой почечной недостаточности для предотвращения возможных осложнений. Раннее (профилактическое) проведение диализа часто упрощает ведение больного, создавая возможность более .либерального подхода к обеспечению поступления в организм соответствующих количеств калия и жидкости и позволяя добиться улучшения общего самочувствия больного. Абсолютными показаниями к проведению диализа являются симптоматическая уремия (обычно проявляющаяся симптомами со стороны центральной нервной системы и/или желудочно-кишечного тракта); развитие резистентной гиперкалиемии, тяжелой степени ацидемии или накопление в организме избыточного количества жидкости, не поддающееся медикаментозному воздействию, и перикардит. В дополнение к этому во многих медицинских центрах стараются поддерживать преддиализные уровни АМК и креатинина в сыворотке крови соответственно менее 1000 и 80 мг/л. Для обеспечения адекватной профилактики уремических симптомов больным без олигурии и катаболизма проведение диализа может потребоваться лишь в редких случаях, а больным, состояние которых отягощено катаболизмом и травмами, может потребоваться ежесуточное выполнение диализа. Часто перитонеальный диализ служит приемлемой альтернативой гемодиализу. Перитонеальный диализ может быть особенно полезен больному с некатаболической почечной недостаточностью, которому показано нечастое проведение диализа. Для контролирования объема внеклеточной жидкости у больных с острой почечной недостаточностью можно использовать медленную непрерывную фильтрацию крови при помощи высокопроницаемых фильтров. Имеющиеся в настоящее время в продаже фильтры, подключаемые к кровеносной системе через артериовенозный шунт, позволяют выводить от 5 до 12 л ультрафильтрата плазмы крови в сутки без использования насоса. Поэтому такие устройства, по-видимому, особенно полезны для лечения больных, страдающих олигурией и обладающих повышенным объемом внесосудистой жидкости и нестабильной гемодинамикой.
Профилактика. Профилактическая терапия заслуживает особого внимания из-за высоких показателей заболеваемости и смертности среди больных с острой почечной недостаточностью. Во время войны во Вьетнаме среди военнослужащих произошло пятикратное снижение показателей смертности, вызванной острой почечной недостаточностью, по сравнению с аналогичными показателями, имевшими место во время войны в Корее. Такое снижение смертности происходило параллельно с обеспечением более ранней эвакуации раненых с поля боя и более раннего увеличения объема внутрисосудистой жидкости. Поэтому очень важно своевременно выявить больных с высоким риском развития острой почечной недостаточности, а именно: больных с множественными травмами, ожогами, рабдомиолизом и внутрисосудистым гемолизом; больных, получающих потенциальные нефротоксины; больных, подвергшихся хирургическим операциям, в ходе которых возникла необходимость во временном прерывании почечного кровотока. Особое внимание следует уделять поддержанию у таких больных оптимальных значений объема внутрисосудистой жидкости, минутного объема сердца и нормального тока мочи. Осторожность при использовании потенциально нефротоксических лекарственных средств, раннее лечение в случае кардиогенного шока, сепсиса и эклампсии также могут снизить частоту развития острой почечной недостаточности.
Острая почечная недостаточность при беременности. Чаще всего острая почечная недостаточность развивается в ранней или поздней стадии беременности. В I триместре беременности острая почечная недостаточность обычно развивается у женщин после криминального аборта в нестерильных условиях. В этих случаях в развитие острой почечной недостаточности вносят свой вклад уменьшение объема внутрисосудистой жидкости, сепсис и нефротоксины. Распространенность этой формы острой почечной недостаточности заметно уменьшилась в настоящее время благодаря широкой доступности выполнения аборта в условиях медицинского учреждения.
Острая почечная недостаточность может также развиться в результате обширного послеродового кровотечения или преэклампсии в поздних стадиях беременности. У большинства больных с этим типом острой почечной недостаточности обычно происходит полное восстановление функции почек. Однако у небольшого числа беременных женщин, страдающих острой почечной недостаточностью, функция почек не восстанавливается, и в этих случаях при гистологическом исследовании выявляют диффузный некроз коры почек. Наличие массивного кровотечения при отслойке плаценты обычно осложняет это состояние. Наряду с этим обнаруживают клинические и лабораторные признаки внутрисосудистого свертывания крови.
Была описана редкая форма острой почечной недостаточности, развившейся через 1—2 нед после неосложненных родов, получившая название послеродового гломерулосклероза. Эта форма болезни характеризуется необратимой быстропрогоессирующей почечной недостаточностью, хотя были описаны и менее тяжелые случаи Как правило, больные страдают сопутствующей микроангиопатической гемолитической анемией. Гистопатологические изменения в почках при этой форме почечной недостаточности неотличимы от аналогичных изменении, возникающих при злокачественной гипертензии или склеродермии. Патофизиология этого заболевания не установлена. Не существует также методов лечения больных, которые обеспечивали бы постоянный успех, хотя считается целесообразным применение гепарина.
Гепаторенальный синдром. Гепаторенальный синдром представляет собой серьезное осложнение прогрессирующего поражения печени, при котором происходит развитие почечной недостаточности в отсутствие клинических, лабораторных или анатомических признаков каких-либо иных причин дисфункции почек. Такая почечная недостаточность обычно сопровождается олигурией, наличием обычного осадка мочи и низкой концентрацией натрия в моче (менее 10 ммоль/л). Болезнь развивается при запущенном циррозе печени, осложненном желтухой, асцитом и печеночной энцефалопатией. Иногда этот синдром может быть осложнением молниеносного гепатита. Механизм этого вида почечной недостаточности неизвестен. Отсутствие стойких гистопатологических изменений в почках больных и восстановление нормальной функции почек в тех случаях, когда почки страдающих гепаторенальным синдромом доноров трансплантируются реципиентам со здоровой печенью, позволяет предположить, что данное нарушение имеет функциональный характер.
Лечение больных с гепаторенальным синдромом обычно бывает безуспешным При лечении больных с циррозом печени следует соблюдать осторожность, чтобы не вызвать значительного изменения объема внутрисосудистой жидкости посредством проведения лапароцентеза или агрессивного диуреза, т. е. процедур, способных ускорить развитие гепаторенального синдрома. Поскольку этот синдром имитирует преренальную азотемию, можно считать оправданной осторожную попытку добиться увеличения объема внутрисосудистой жидкости. В некоторых случаях происходило восстановление функции почек после портокавального шунтирования наложения абдоминально-венозного шунта (Leveen) или длительного гемодиализа. Однако эти виды лечения не прошли достаточного изучения в контролируемых исследованиях. Наложение абдоминально-венозного шунта может быть связано с развитием перитонита, внутрисосудистым свертыванием крови и застоем крови в легких. Улучшение функции печени часто сопровождается одновременным улучшением функции почек. Следует предпринять все возможные усилия чтобы убедиться в отсутствии более специфических и поддающихся коррекции причин одновременной дисфункции печени и почек, таких как инфекционные болезни (лептоспироз. гепатит, сопровождающийся болезнью иммунных комплексов), токсины (аминогликозиды, тетрахлорметан) и нарушения кровообращения (тяжелая сердечная недостаточность, шок). Следует также иметь в виду, что страдающие желтухой и болезнями печени лица особенно чувствительны к острому некрозу почечных канальцев.
Дата добавления: 2015-03-17; просмотров: 865;
